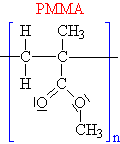
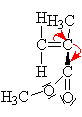| Schématický
zápis: |
| n |
 |
|
 |
|
| Základní
pravidlo: |
| Platí zásada, že
sloučenina se "snaží" mít co nejmenší náboj
a pokud má existovat ion (ať už kation nebo anion)
"ochotněji" vznikne tam, kde je náboj
kompenzován částečným nábojem opačného znaménka,
neboli tam, kde je náboj v absolutní hodnotě menší
než jedna (Porovnej s
vlivem efektů u alkoholů u kyselin a u aminosloučenin).
Proč je napadán mer
aniontem? Je to pro -
I efekt, který způsobuje
kyslík na oxo skupině pro svoji velkou
elektronegativitu. Ten způsobí snížení elektronové
hustoty (částečně kladný náboj d+) nejen
na karbonylovém uhlíku,ale i na uhlíku dvojné
vazby,na který je karbonylová skupina vázána. Z výše uvedeného plyne, že více
vadí a proto je snadněji napadnutelný uhlík, na který
se neváže karbonylový uhlík, neboť tam není náboj
při přesunu dvojné vazby ani částečně kompenzován.
Tento náboj je kladný a proto ho napadne anion. |
|
|
| Přehledný
podrobný zápis: |
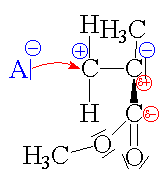
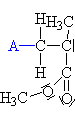
| Iniciace: Iniciátor
A-
napadá mer. |
|
|
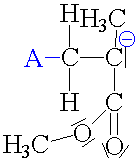
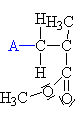
| Propagace: Po
napadnutí meru aniontem se vytvoří již objemnější
karboanion. Reakce pokračuje s dalším merem atd. pořád
dokola a karboanion se zvětšuje. |
|
|
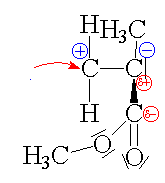
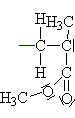
| Terminace:
Kation se napojí
na karboanion a výstavba makromolekuly se se tak ukončí(pozn.:
pro matemtické dogmatiky: počet merů v polymeru je tak
velký, že lze klást na roveň n a n+2 v dolním vyčíslení). |
|
|
| Příklady s
konkrétním zadáním iniciátoru ( Lewisova
kyselina ) s amidy , s alkalickými
kovy , s organokovy , s hydridy ). |