| Schématický
zápis: |
| n |
 |
| kokatalyzátor CH3Cl,
katalyzátor AlCl3
|
|
|
 |
| |
|
 |
|
| Základní
pravidlo: |
| Platí zásada, že
sloučenina se "snaží" mít co nejmenší
náboj a pokud má existovat ion (ať už kation nebo
anion) "ochotněji" vznikne tam, kde je náboj
kompenzován částečným nábojem opačného znaménka,
neboli tam, kde je náboj v absolutní hodnotě menší
než jedna (Porovnej s
vlivem efektů u alkoholů u kyselin a u aminosloučenin).
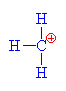
Proč je napadán mer
kationtem? Je to pro +
I efekt, který způsobuje
methylová skupina. Ta způsobí zvýšení elektronové
hustoty (částečně záporný náboj d-) na
uhlíku na než se váže. Z výše uvedeného plyne, že
více vadí a proto je snadněji napadnutelný uhlík, na
který se neváže methylová skupina, neboť tam není
náboj ani částečně kompenzován. Tento náboj je
záporný a proto ho napadne kation. Zároveň uhlík na
než se váže methylová skupina, je vzhledem k
posunutí elektronové hustoty napadán druhou dvojnou
vazbou. |
|
|
|
|
| Přehledný
podrobný zápis: |
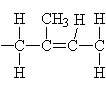
| Iniciace: Pro
zahájení reakce se vytváří kation reakcí
kokatalyzátoru (zde methylchlorid) s katalyzátorem Lewisovou
kyselinou ( zde chlorid hlinitý). |
|
|
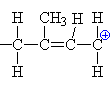
| Propagace: Po
napadnutí meru karbokationtem se vytvoří již
objemnější karbokation. Reakce pokračuje s dalším
merem atd. pořád dokola a karbokation se zvětšuje. |
|
|
|
|
| Terminace:
Anion se napojí
na karbokation a výstavba makromolekuly se se tak
ukončí(pozn.: pro matemtické dogmatiky:
počet merů v polymeru je tak velký, že lze klást na
roveň n a n+1 v dolním vyčíslení). |
|
|
| zde další
varianty polymerace polyisoprenu s BF3
, AlCl3 , SnCl4 , TiCl4). |