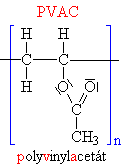
| Schématický
zápis: |
| n |
 |
|
 |
|
| Základní
pravidlo: |
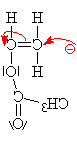
| Proč je napadán mer
alkalickým kovem? Je to pro - I efekt, který
způsobuje kyslík pro svoji velkou
elektronegativitu, podporován navíc
oxoskupinou. . Ten způsobí snížení
elektronové hustoty (částečně
kladný náboj d+) na uhlíku na
nejž se váže a přesouvá se tam vazba p mezi uhlíky. Druhý uhlík tak
odhaluje jádro (náboj plus) a velmi ochotně
proto přijímá elektron od sodíku. |
 |
|
| Podrobný
zápis: |
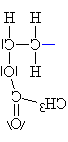
| Iniciace: Silně
neušlechtilý sodík odevzdává elektron meru.Kromě
sodíkového kationtu vznikne radikálový
karboanion. |
|
|
| Oba radikálové
karboanionty se spojí a vznikne
oboustranný dvojsytný karboanion |
|
|
| Propagace: Po
napadnutí meru aniontem se vytvoří již objemnější
oboustranný dvojsytný karboanion. Reakce pokračuje s
dalším merem atd. pořád dokola a karboanion se
zvětšuje. |
|
|
| Terminace: Reakce
se ukončuje reakcí např. s alkoholy |
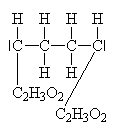
| Příklady: obecně,
s amidy , s alkalickými
kovy , s organokovy , s hydridy ). |