| Schématický zápis: |
| C3H5(OH)3 + 3 HNO3 |
|
C3H5(ONO2)3 |
|
| Podrobný zápis
(při zanedbání vlivu katalyzátoru kyseliny sírové
na mechanismus reakce): |
| Kyselina
dusičná se chová jako
kyselina a glycerol
jako zásada, to
znamená, že volné elektronové páry na atomech kyslíku
v glycerolu
přijímají vodík a vzniká trioxoniový kationt glycerolu
(kyslíky mají pouze 5 elektronů a proto mají náboje
plus). Chybějící elektron získávájí heterolytickým
odštěpením od uhlíku. |
 |
 |
1,2,3-trioxoniumpropantrinitrát
 |
|
|
| |
|
|
 |
| |
-3 H2O |
|
|
| Vzniklý karbokation se spojuje s nitrátovými
anionty za vzniku anorganického esteru glycerolu a
kyseliny dusičné. |
| |
|
|
 |
| |
-3 H2O |
|
 |
|
|
 |
glycerotrinitrát
(nitroglycerin) |
 |
|
|
| Podrobný zápis (uvažující i vliv kyseliny sírové
na mechamismus reakce): |
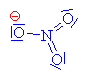
| Kyselina sírová
a kyselina dusičná
vytváří tzv. nitrační směs. Kyselina sírová
daruje vodíkový kation (Lewisova kyselina) kyselině dusičné
(Lewisova kyselina)-
váže se na volný elektronový pár u kyslíku v
hydroxyskupině |
|
|
|
|
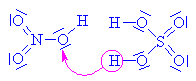
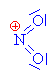
| Kation odštěpuje vodu a vzniká
tak nitroniový kation, který je elektrofilním činidlem |
|
|
| Nitroniové kationty napadají volné elektronové páry
u kyslíků v hydroxyskupinách glycerolu. U vzniklého
karbokationtu se poté odštěpují vodíkové kationty. |
 |
 |
1,2,3-trinitrooxoniumpropan
 |
|
| |
|
|
 |
| |
-3 H+ |
|
|
glycerotrinitrát
(nitroglycerin) |
 |
|
|
|
| Odštěpený vodíkový kation se napojuje na hydrogensulfátový anion
a za vzniku kyseliny sírové
(ta tedy slouží jako katalyzátor) a ta rozbíhá další kolo reakce |
|
|