| Doporučuji
prostudovat nejdříve teorii. |
|
|
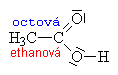
Chlorderiváty
kyselin: U
kyseliny chloroctové způsobuje chlor na a uhlíku
odčerpávání elektronové hustoty , které se
přenáší až na hydroxylový kyslík. Substituent
chlor tudíž způsobuje - I
efekt. To znamená že
oproti kyselině
octové (pouze
tento rozdíl je značen) se
snížila elektronová hustota na kyslíku
odštěpujícím vodíkový kation (částečně kladný
náboj d-).
Částečně kladný náboj způsobuje, že při
odštěpení vodíkového kationtu by vznikl náboj v
absolutní hodnotě menší než jedna.
| náboj aniontu
kyseliny je /-1+d/
< /-1/ |
To
znamená, že - I efekt odštěpování usnadní,
kyselina chlóroctová má
menší pK
(záporný dekadický
logaritmus disociační konstanty kyseliny)
a při stejné koncentraci i menší pH
než kyselina octová. Kyselina
chloroctová je silnější než kyselina octová.
|
|
|
U
kyseliny dichloroctové způsobují dva chlóry na a uhlíku
2x - I efekt. To
znamená že oproti kyselině chlóroctové se
dvojnásobně snížila elektronová hustota na kyslíku
odštěpujícím vodíkový kation (dvojnásobný
částečně kladný náboj d-).
Dvojnásobný částečně kladný náboj způsobuje, že
při odštěpení vodíkového kationtu by vznikl náboj
v absolutní hodnotě více menší než jedna.
| náboj aniontu
kyseliny je /-1+2xd/<
< /-1/ |
To
znamená, že dvojnásobný - I efekt odštěpování
usnadní, kyselina dichlóroctová má
menší pK
(záporný dekadický
logaritmus disociační konstanty kyseliny)
a při stejné koncentraci i menší pH
než kyselina chloroctová. Kyselina
dichloroctová je silnější než kyselina chloroctová.
| pKCHCl2COOH <
pKCH2ClCOOH |
|
|
|
U
kyseliny trichloroctové způsobují tři chlóry na a uhlíku
3x - I efekt. To
znamená že oproti kyselině
dichlóroctové se jedenapůlnásobně
snížila elektronová hustota na kyslíku
odštěpujícím vodíkový kation (celkem trojnásobný
částečně kladný náboj d-).
Tento větší částečně kladný náboj způsobuje,
že při odštěpení vodíkového kationtu by vznikl
náboj v absolutní hodnotě více menší než jedna.
| náboj aniontu
kyseliny je /-1+3xd/<<
< /-1/ |
To
znamená, že trojnásobný - I efekt odštěpování
usnadní, kyselina trichlóroctová má
menší pK
(záporný dekadický
logaritmus disociační konstanty kyseliny)
a při stejné koncentraci i menší pH
než kyselina dichloroctová. Kyselina
trichloroctová je nejsilnější ze všech
karboxylových kyselin.
|
|
|
Nitroderiváty
kyselin: Nitroskupina
patří mezi ty, jež odčerpávají elektronovou hustotu
a tak způsobují - I efekt (jiný
př. karboxyskupina - viz. dikarboxylové
kyseliny). To znamená že
oproti kyselině
octové (pouze
tento rozdíl je značen) se
snížila elektronová hustota na kyslíku
odštěpujícím vodíkový kation (částečně kladný
náboj d-).
Částečně kladný náboj způsobuje, že při
odštěpení vodíkového kationtu by vznikl náboj v
absolutní hodnotě menší než jedna.
| náboj aniontu
kyseliny je /-1+d/
< /-1/ |
To
znamená, že - I efekt odštěpování usnadní,
kyselina nitrooctová má
menší pK
(záporný dekadický
logaritmus disociační konstanty kyseliny)
a při stejné koncentraci i menší pH
než kyselina octová. Kyselina
nitroctová je silnější než kyselina octová.
|
|
|
| Efekty proti sobě: Efekty mohou působit i proti sobě.Jako ve zde
uvedeném příkladu kyseliny a alkylkarboxylové. +I efekt (alkylový
zbytek) a -I efekt (chlor).
Rozhodující je velikost jednotlivých efektů. Vliv - I
efektu od chlóru by velmi podstatně klesl, kdyby chlor
nebyl na a, ale byl na b
či dokonce na g uhlíku. |
|
|