kJ/mol
nm
 |
 |
 |
 |
 |
 |
Teorie
barevnosti
[teorie barevnosti][nitro a nitroso][polymethinová][arylmethanová][chinoninová][azo][azomethinová][antrachinonová] [anthrapyridonová][kypová][sirná][ftalocyaninová][barviva]
Fyzikální základy
barevnosti
Rozdílní interakce barviv jsou
důsledkem pohlcení části záření (to tvoří proud fotonů,
tj.kvant energie) o určité vlnové délce. Lidské oko je
schopné vnímat záření o vlnové délce 400 až 760 nm.
Záření o vlnové délcer pod 400 nm je ultrafialové záření
(UV), záření nad 760 nm je infračervené (IČ). Záření v
těchto oblastech nevyvolává zrakové vjem a je pro lidské oko
neviditelné. Pokud je záření v celém intervalu viditelného
světle, jeví se jako bílé. Záření o vlnových délkách v
intervalu viditelného světla vyvolává zrakový dojem uvedený
v tabulce. Je zde uvedena i barva doplňková, která se
vytvoří smíšením nepohlceného světla. Pokud předmět
pohltí z bílého záření, záření o určité vlnové
délce, odráží se do oka zbývající část a oko má vjem
doplňkové barvy.
| vln.d. [nm] | barva | doplňková |
| 400 - 435 | fialová | zelenožlutá |
| 435 - 480 | modrá | žlutá |
| 480 - 490 | zelenomodrá | oranžová |
| 490 - 500 | modrozelená | červená |
| 500 - 560 | zelená | purpurová |
| 560 - 580 | zelenožlutá | fialová |
| 580 - 595 | žlutá | modrá |
| 595 - 605 | oranžová | zelenomodrá |
| 605 - 730 | červená | modrozelená |
| 730 - 760 | purpurová | zelená |
S vlnovou délkou světla
souvisí frekvence záření
n= c/l.
Elektromagnetická energie
souvisí s frekvencí následovně
E = h.n
či s vlnovou délkou
E= h.c/l
Energetické hladiny
molekul
Molekula vždy přijímá takové
kvantum energie, která se rovná přechodu molekuly ze
základního stavu do stavu vzbuzeného (přechod z jedné
energetické hladiny na druhou). Platí, že pro přechod jednoho
molu molekul ze základního do excitačního stavu je třeba excitační
energie
E= NAh.c/l
Z výpočtu pak vychází, že
hranice, kdy se jeví látka barevná odpovídá excitační
enerii 158 až 300 kJ/mol
Konjugovaný systém
V molekulách s konjugovanými
dvojnými vazbami vytváří elektrony p společný elektronový mrak, čímž
se stupeň jejich delokalizace zvětšuje a excitační energie
se zmenšuje. To znamená, že se tak zároveň zvětšuje
vlnová délka pohlcovaného světla. Čím více je pak
dvojných vazeb, tím je konjugovaný systém ,a tím i vlnová
délka pohlcovaného světla, delší.
| n | Energie kJ/mol |
lmax nm |
barva | |
| butadien | 2 | 739 | 217 | bezbarvý |
| hexatrien | 3 | 481 | 258 | bezbarvý |
| oktatetraen | 4 | 379 | 302 | bezbarvý |
| vitamín A | 5 | 366 | 328 | světle žlutý |
| likopen | 11 | 237 | 506 | červený |
Obdobné platí i pro konjugované systémy arénů
| Energie kJ/mol |
lmax nm |
barva | ||
benzen
|
471 | 255 | bezbarvý | |
naftalen
|
383 | 311 | bezbarvý | |
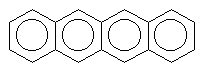
anthracen
|
324 | 370 | bezbarvý | |
tetracen
|
261 | 460 | oranžový | |
pentacen
|
207 | 560 | fialový | |
hexacen
|
173 | 693 | modrozelený |
Elektrondonorové
substituenty
Elektrodononorové substituenty
jsou substituenty I. třídy a způsobují +M příp. +I
efekt.. Elektrony ze
substituentů se zapojují do konjugovaného systému.
Excitační energie se snižuje a proto se vlnová délka
pohlcovaného světla zvyšuje.
| lmax nm |
|||
| benzen | 255 | naftalen | 320 |
| toluen | 261 | 1-methylnaftalen | 322 |
| anilin | 280 | 2-methylnaftalen | 324 |
| N,N-dimethylanilin | 298 | ||
| fenol | 275 | ||
| anisol | 270 |
Elektronakceptorové
substituenty
Elektronakceptorové substituenty
jsou substituenty II. třídy a způsobují -M příp. -I
efekt.. Elektrony ze
substituentů se vytahují z konjugovaného systému. Hladiny
základního a excitovaného stavu se tak přibližují a tak je
výsledek vlastně shodný jako u elektrodononorových
substituentů. Vlnová délka pohlcovaného světla zvyšuje.
| lmax nm |
|
| benzen | 255 |
| nitrobenzen | 261 |
| nitosobenzen | 280 |
| kyselina benzoová | 298 |
| benzonitril | 275 |
| acetofenon | 270 |
[teorie barevnosti][nitro a nitroso][polymethinová][arylmethanová][chinoninová][azo][azomethinová][antrachinonová] [anthrapyridonová][kypová][sirná][ftalocyaninová]
[barviva]
[nahoru][indikátory][organická chemie][go
home]
![]()