10.2.8.4 P-kopulace
P-kopulace probíhá při tvorbě azofosfonických esterů ArN2PO(OCH3)2 z diazoniové sole a dimethylesteru kyseliny fosforité HPO(OCH3)2, rovněž tak při reakci diazoniové sole s terciárními fosfíny (obrázek 10-63).

Obrázek 10-63. Reakce diazoniové sloučeniny s trifenylfosfinem
P-azo produkt je nestabilní a hydrolyzuje.
Díky možné delokalizaci elektronů lze připravit stabilní P-diazosloučeniny z 1,4-chinondiazidu (obrázek 10-64).
Obrázek 10-64. Příprava stabilních P-diazosloučenin
10.2.8.5 C-kopulace
Jedná se o velmi důležitou reakci, kterou se připravují azobarviva. Při této reakci reaguje diazoniový kationt s tzv. pasivní komponentou (angl. secondary component nebo coupling component). Pasivní komponentou je obvykle aromatický amin a nebo fenol. Jedná se o reakci na sp2 hybridizovaném uhlíku (elektrofilní aromatická substituce) a věnujeme jí jednu celou samostatnou kapitolu.
Zde se zmíníme pouze o C-kopulaci mezi diazoniovou solí a kyanidem (obrázek 10-65).
Obrázek 10-65. Příprava arendiazokyanidu
Nalejeme-li koncentrovaný roztok diazoniové sole do koncentrovaného roztoku kyanidu draselného při 0oC, začne krystalovat Z-arendiazokyanid (! zde hlavně čtenáře upozorňujeme, aby nenalili kyselý roztok diazoniové sole do roztoku kyanidu, nebo by to byla jejich poslední reakce). Z-izomer se přeměňuje na E-izomer. Hydrolýzou obou izomerů (např. povařením ve vodě) se získají diazokarbamidy Ar-N2-CONH2.
10.2.8.6 Intramolekulární N-kopulace
Intramolekulární N-kopulace je odpovědná za vznik triazolu (obrázek 10-66).

Obrázek 10-66. Příprava triazolů
Benzotriazoly mohou existovat ve dvou tautomerních formách (obrázek 10-67).

Obrázek 10-67. Tautomerní rovnováhy H-benzotriazolu
Dominantní je 1-H-benzotriazol na rozdíl od obyčejných triazolů, kde je naopak dominantní 2-H-tautomer.
Obdobně se tvoří naftotriazoly (obrázek 10-68).

Obrázek 10-68. Vznik naftotriazolu
Rychlost určujícím krokem je ve výše uvedeném mechanismu diazotace.
Obdobným mechanismem vznikají sloučeniny typu benzo-1,2,3-triazin-4-on (obrázek 10-69).
Obrázek 10-69. Vznik sloučenin typu benzo-1,2,3-triazin-4-on
10.2.8.7 Intramolekulární O-kopulace
Teprve v posledních letech (1979® ) bylo zjištěno, že diazotací o-aminofenolu a jeho kondenzací ve vakuu při 15 K v Ar atmosféře vzniká 1,2,3-benzooxadiazol (obrázek 10-70)
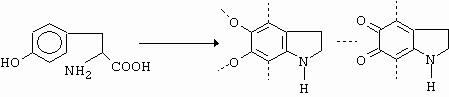
Obrázek 10-70. Příprava 1,2,3-benzooxadiazolu
10.2.8.8 Intramolekulární S-kopulace
Na rozdíl od o-aminofenolu, diazotací 2-aminothiofenolu vůbec nezachytíme diazo-thiofenolát a rovnou vzniká stabilní benzo-1-thio-2,3-diazol (obrázek 10-71).
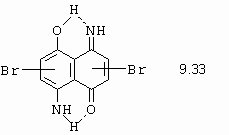
Obrázek 10-71. Příprava benzo-1-thio-2,3-diazolu
Velmi zajímavý přesmyk nastává diazotací 7-amino-benzothiazolu (obrázek 10-72).
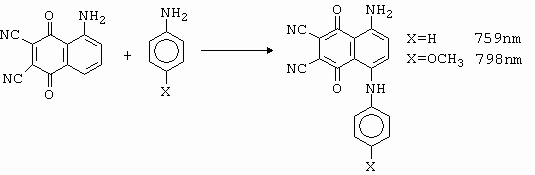
Obrázek 10-72. Diazotace 7-amino-benzothiazolu
Pokračujeme-li v diazotaci podobné sloučeniny, dojde k migraci "kruhu" (obrázek 10-73).

Obrázek 10-73. Diazotace 6-alkyl-7-amino-benzo-1,2,3-thiadiazolu
10.2.8.9 Intramolekulární C-kopulace
Nejdůležitější intramolekulární C-kopulací je příprava 4,5-benzopyrazolů, dříve označeny jako indazoly (obrázek 10-74).
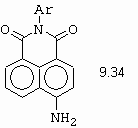
Obrázek 10-74. Příprava 4,5-benzopyrazolů substituovaných elektron-
akceptorními skupinami
Diazotace 2-methylanilinu se provádí ve vodě nebo ledové kyselině octové (ledová v tomto případě znamená 100 %ní) a následuje cyklizace za alkalických podmínek. Indazoly lze syntetizovat pouze tehdy, je-li skupina X elektronakceptorní (X = halogen, NO2, atd.).
Indazoly samotné, a nebo deriváty s elektrondonorními skupinami lze získat Jacobsonovou modifikací, kde se začíná z N-acetyl derivátu (obrázek 10-75).
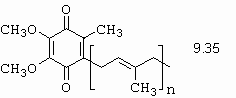
Obrázek 10-75. Příprava 4,5-benzopyrazolu nebo derivátů substituovaných
elektron-donorními skupinami
Znalost mechanismu vedla k úpravě syntézy, a to tak, že k vroucímu roztoku 2-methylanilinu v benzenu se pomalu přikape 1,5 ekvivalentu 2-pentylnitritu, kde je ještě 1 ekvivalent bezvodého octanu draselného a 3 ekvivalenty acetanhydridu. Vaříme pod refluxem 18 hodin. Produktem je 1-acetyl-indazol, který hydrolýzou (7 M HCl, 50 - 60 oC) poskytne indazol. Výtěžek je 80 %.
Indazolová syntéza je aplikována při přípravě 1,2-diaza naftalenu tzv. chinolinů (obrázek 10-76).

Obrázek 10-76. Příprava 4-fenylchinolinu
10.3 Azokopulační reakce
Jak už bylo řečeno v předešlé kapitole, jedná se o C-kopulaci na sp2 hybridizovaném uhlíku. Z hlediska mechanismu se jedná o elektrofilní aromatickou substituci (obrázek 10-77), kde elektrofil ArN2+ je slabý (v porovnání např. s NO2+, Cl+, atd.).
Obrázek 10-77. Mechanismus azokopulační reakce
Znamená to, že reakce probíhá pouze v případě, kdy je stabilizován aktivovaný komplex elektron-donorní skupinou Y. Proto pasivními komponentami jsou v podstatě pouze aromatické aminy a fenoly, naftoly, fenoláty a naftoláty, kde Y = O-, NR2, NHR, NH2, OH (v uvedené řadě klesá rychlost kopulace).
Z hlediska rychlosti reakce naopak elektron-akceptorní skupiny na diazoniové komponentě (aktivní) urychlují rychlost kopulace (zvyšují kladný náboj), X = NO2, CN, COCH3, Cl, atd. Naopak elektron-donorní skupiny na diazoniové komponentě rychlost kopulace zpomalují (ale stále mohou, by» pomaleji, probíhat).
Kapitolou samo o sobě jsou heterocyklické aminy jako aktivní komponenty, kde již v předcházející kapitole jsme vyložili, že tyto heterocykly jsou obvykle velmi silnými elektron-akceptory a tudíž vzniklé diazoniové kationty jsou velmi reaktivní.
Rovněž v předcházející kapitole jsme vyložili, že přítomnost OH skupiny v o- nebo p- poloze diazoniové skupiny drasticky sníží reaktivitu a tím i rychlost kopulace.
10.3.1 Pasivní komponenty
Fenoly, fenoláty, naftoly, naftoláty jsou v alkalickém roztoku v rovnováze (obrázek 10-78).

Obrázek 10-78. Rovnováha mezi fenolem a fenolátem
Na následujícím obrázku 10-79 vidíme rychlost kopulace 4-toluendiazoniového iontu s 2,6-naftolsulfonovou kyselinou.


Obrázek 10-79. Závislost pozorované rychlostní konstanty kopulace naftolu
na pH reakční směsi
Vidíme, že s rostoucím pH rychlost kopulace nejprve roste tak, jak se posouvá rovnováha naftol/naftolát ve prospěch vyšší koncentrace naftolátu. Při pH nad hodnotu 13 se naopak rychlost kopulace snižuje a to se čtvercem koncentrace OH- iontů, protože se uplatní rovnováhy tvorby diazohydroxidu (pK1) a a diazotátu (pK2) (viz acidobázické rovnováhy diazoniových sloučenin).
Vliv pH na rychlost kopulace aromatických aminů, a také bifunkčních komponent ukážeme na příkladu kopulace aminonaftolového derivátu (obrázek 10-80).
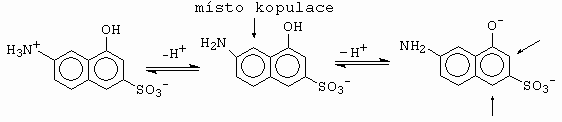

Obrázek 10-80. Závislost pozorovaných rychlostních konstant kopulace
bifunkční pasivní komponenty na pH reakční směsi
Z obrázku je vidět, že v kyselé oblasti lze provést kopulaci k aminoskupině, aniž by vznikal derivát kopulace k OH skupině. Je-li OH skupina disociována (O-), je rychlost kopulace k aminoskupině 5x až 6x nižší. Proto, syntetizujeme-li nesymetrická disazobarviva, odvozená např. od H-kyseliny, jako první kopulaci provádíme kopulaci v kyselém prostředí.
Do které polohy na pasivní komponentě půjde kopulace je zřejmé - jedná se o o- a p-polohy vzhledem k elektron-donorní skupině. Méně zřejmá je ovšem rychlost kopulace do těchto poloh. Náseledující obrázek ukazuje příklad rychlostí kopulace pro 1-naftol (obrázek 10-81).

Obrázek 10-81. Kopulace 1-naftolu do poloh ortho a para
Zde k1o = 9,21 . 105 l/(mol.s),
k1p = 122,38 . 105 l/(mol.s),
k2p = 0,2225 . 105 l/(mol.s),
k2o = 0,01835 . 105 l/(mol.s).
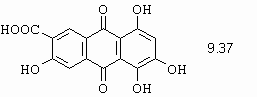
Na následujícím třístránkovém obrázku 10-82 je ukázáno několik hlavních pasivních komponent benzenové a naftalenové řady a polohy kopulace.
 |
Kopulují jednoznačně do polohy 1, je-li tato poloha obsazena snadno odstupující skupinou (COOH, SO3H) jsou tyto skupiny vytěsňovány a nahrazeny arylazoskupinou (Ar-N=N-). |
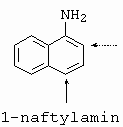 |
Kopuluje do polohy 4, avšak tvoří se i značné množství o-aminoazobarviva (poloha 2), které jako nežádoucí produkt vzniká tím méně, čím je nižší teplota kopulace a čím nižší je kyselost reakční směsi. |
 |
Azoskupina
vstupuje obvykle do polohy 4, avšak při vyšší
koncentraci alkálií se také tvoří trochu
disazobarviva (+poloha 2), což způsobí hlubší a
kalný odstín. Aby se získalo čisté monoazobarvivo,
používá se 1-naftol v octově kyselé suspenzi (pokud
ovšem kopulace za těchto podmínek vůbec probíhá). Vyjímku tvoří kopulace s diazoniovou sloučeninou od 1,2,4-aminonaftolsulfokyseliny (nebo jejího nitro derivátu), která jde pouze do polohy 2. |
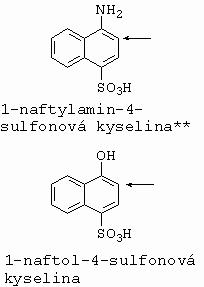 |
Kopulují pouze do polohy 2. |
 |
Kopulují převážně do polohy 2, zčásti do polohy 4. Místo kopulace je ovšem ovlivněno reaktivitou diazoniové sloučeniny. Málo reaktivní ArN2+ vstupují do polohy 2, velmi reaktivní naopak do polohy 4. |
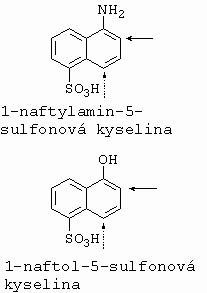 |
Poloha kopulace
závisí na prostředí. 1-naftol-5-sulfonová kyselina
tvoří s diazoniovou sloučeninou aryldiazosulfonát
který působením sody poskytne o-hydroxyazobarvivo, zatímco působením louhu p-hydroxyazobarvivo. |
 |
Kopulace probíhá do polohy 1. |
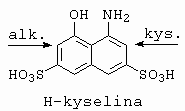 |
Kopuluje v
kyselém prostředí do polohy ortho k aminoskupině. V
slabě alkalické prostředí do polohy ortho k
hydroxyskupině. Postupnou kopulací nejprve v kyselém a
pak alkalickém prostředí se získá disazobarvivo.
Nelze otočit, protože o-hydroxymonoazobarvivo již
dále nekopuluje. H-kyselinu lze diazotovat. |
 |
V kyselém
prostředí kopuluje do polohy 1, v alkalickém
prostředí do polohy 6. V hodně silném alkalickém
prostředí do polohy 8. Podobně jako u H-kyseliny lze
připravit i 1,6-disazobarvivo. I kyselinu lze diazotovat jakož její o-hydroxy- monoazobarvivo. |
 |
V kyselém
prostředí kopuluje do polohy 1, v alkalickém
prostředí do polohy 7. Tvoří pouze monoazobarviva. g -Kyselinu lze diazotovat jakož její o-hydroxy- monoazobarvivo. |
 |
Tvoří pouze o-hydroxymonoazobarviva, i když existují struktury, kde autoři tvrdí, že připravili (podobně jako u H-kyseliny) disazobarviva. |
 |
Kopuluje převážně do polohy 4, zčásti do polohy 2. Je-li poloha 4 obsazena snadno odstupující skupinou (SO3H, COOH), potom dojde k její substituci arylazoskupinou. |
 |
Tvoří s
diazoniovými sloučeninami triazeny
které za určitých podmínek přesmykují na převážně p-aminoazosloučeniny. |
 |
Kopuluje pouze do polohy 4. Je-li poloha 4 obsazena snadno odstupující skupinou (SO3H, COOH), potom dojde k její substituci arylazoskupinou. |
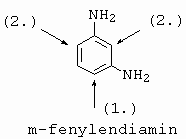 |
Při kopulaci vstupuje azoskupina do polohy 4 a potom do polohy 6 nebo 2 (směs dvou disazobarviv). |
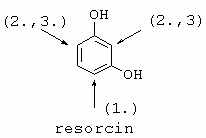 |
Při kopulaci vstupuje azoskupina do polohy 4 (v hodně alkalickém prostředí do polohy 2) a potom do polohy 6 nebo 2. Lze zavést i tři azoskupiny do poloh 2,4,6. |
** CAS názvosloví je 1-naphtalenesulfonic acid, 4-amino-. My jsme ponechali staré barvářské názvosloví, které je používané ve starších učebnicích.
Obrázek 10-82. Nejpoužívanější pasivní komponenty a místo jejich kopulace
Kinetika kopulace je ukázána na kopulaci 2-naftolátu (obrázek 10-83).

Obrázek 10-83. Kopulace 2-naftolátu
Je-li s -komplex přítomen v reakční směsi v malé, ale konstantní koncentraci, pak pomocí Bodensteinova principu ustáleného stavu platí:
-d/[ ArN2+] / dt = [ ArN2+] *[ Naft-O-] * ( k1k2*[ B] / (k-1+k2*[ B] ) ).
Reakce např. 4-chlorbenzendiazonium chloridu s 1-naftol-4-sulfokyselinou není bázicky katalyzovaná, protože k2*[ B] > > k-1 .
Naopak, při kopulaci téže diazoniové soli s 2-naftol-8-sulfokyselinou je k2*[ B] < < k-1 ,
takže reakce je bázicky katalyzována. Je-li reakce bázicky katalyzována, je vhodné se rozhodnout pro takovou bázi, aniž bychom nevhodně posunuli acido-bázické "předrovnováhy".
Takovou velmi vhodnou bází je např. pyridin, který má strukturu (10.6)
![]()
Volný elektronový pár může "přitáhnout" proton (za tvorby např. pyridinium hydrochloridu), aniž by nějak stericky překážel u vlastního s -komplexu při azokopulaci.
Navíc u takto katalyzovaných reakcí pyridin nejen urychlí reakci, ale navíc ovlivní i pozici kopulace (tabulka 10-1).
Tabulka 10-1. Vliv I-efektu a stérické zábrany při kopulaci
1-naftol-3-sulfokyseliny
|
|
|
Stérická zábrana na reakčním místě |
malá |
velká |
k-1 |
malá |
velká |
-I efekt |
velký |
malý |
k2 |
velká |
malá |
k2*[ B] / k-1 |
velmi velký |
velmi malý |
bázická katalýza |
slabá |
silná |
Kromě aromatických aminů a fenolů, jako pasivní komponenty rovněž slouží sloučeniny mající v molekule aktivovaný uhlík. Jedná se o uhlík mající v okolí silné elektron-akceptorní skupiny. Průmyslově při výrobě azobarviv jako pasivní komponenta tohoto typu slouží pyrazolon a jeho deriváty (obrázek 10-84).

Obrázek 10-84. Deriváty pyrazolonu jako pasivní komponenty
Dále pak jsou to acetoacetanilidy a a pyridony (obrázek 10-85).

Obrázek 10-85. Acetoacetanilidy a pyridony jako pasivní komponenty
Dřívější debata o tom, zda-li kopuluje keto či enolforma, je již dnes ukončena, protože víme, že vlastní bimolekulární srážky se účastní tzv. konjugovaná báze (obrázek 10-86).

Obrázek 10-86. Mechanismus kopulace pyrazolonů
Jako naprostou zajímavost uvádíme, že např. 1,4-dinitrobutan může být kopulován (obrázek 10-87).

Obrázek 10-87. 1,4-Dinitrobutan jako pasivní komponenta
Rovněž aceton může sloužit jako pasivní komponenta a vznikají tzv. formazány (obrázek 10-88).
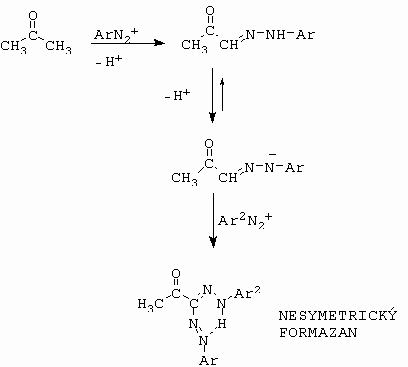
Obrázek 10-88. Příprava formazánů z acetonu
K syntéze formazánů slouží také 2-methylbenzothiazol (obrázek 10-89).

Obrázek 10-89. Příprava formazánů z 2-methylbenzothiazolu
Závěrem lze říci, že optimální pH pro kopulaci aromatických aminů leží v rozsahu 4 - 9, pro enoly v rozsahu 7 - 9, pro fenoly okolo 9 a pro diazofenoly v rozsahu 9 - 12.
[strana 1][strana 2][strana 3][azobarviva][barviva]
![]()