
10 AZOBARVIVA A AZOPIGMENTY
10.1 Úvod
Azobarviva jsou sloučeniny charakterizované azoskupinou -N=N- (obvykle E-forma, trans), která je spojena se systémem sp2 hybridizovaných uhlíků. Podle počtu azoskupin se označují jako monoazobarviva, disazobarviva, trisazobarviva, a polyazobarviva. Obvykle je azoskupina napojena na benzenový či naftalenový kruh, a v současnosti stále více na nějaký heterocyklus.
Azoskupina se v přírodě (v přírodních látkách) nevyskytuje. Známy jsou pouze přírodní sloučeniny obsahující azoxyskupinu -N=N(O)- .
Z hlediska syntetického se dá říci, že velká většina azolátek je připravována azokopulační reakcí diazoniových sloučenin s tzv. pasivní komponentou. V souhlase s tímto se diazoniová sloučenina označuje jako komponenta aktivní.
V Chemical Abstracts jsou azosloučeniny označovány jako "diazenes".
V Colour Indexu jsou u jednotlivých azobarviv (pokud je struktura uvedena) zkráceně popsány syntézy, a to tak, že od aminu určeného k diazotaci (primární amin) vede šipka k pasivní komponentě. Kyselá červeň 1 (C.I. Acid Red 1) je připravována sledem následujících reakcí reakcí (obrázek 10-1).

Obrázek 10-1. Příklad klasické syntézy azobarviv
Zápis v Colour Indexu je pak tento: Aniline ® N-Acetyl-H-acid.
Azobarviva zaujímají největší část trhu s barvivy a pigmenty. Tento jejich úspěch je zapříčiněn snadnou syntézou (diazotace, kopulace), vysokými absorpčními koeficienty, středními světlostálostmi a dobrými stálostmi v praní. U barviv reaktivních slouží pak azosloučeniny jako barevné chromofory.
Diazotaci a diazoniové sloučeniny objevil v roce 1858 Peter Griess a roku 1861 bylo vyrobeno první azobarvivo (anilinová žlu»). Výrobu azobarviv sledem dvou reakcí - diazotací a kopulací - zahájila roku 1865 německá firma BASF.
IUPAC názvosloví barviv je ukázáno na příkladu klasické Oranže II (10.1), která má v angličtině název 4-(2-hydroxy-1-naphtylazo)-benzenesulfonic acid.

10.2 Diazotace aromatických aminů a heteroaromatických aminů
Diazotace primárních aromatických a heteroaromatických aminů je prvním krokem syntézy azobarviv. Aromatický amin je obvykle diazotován ve vodném prostředí dusitanem sodným za přítomnosti minerální kyseliny. Teplota reakce je 0 - 5oC. Minerální kyseliny se obvykle nasazuje více než 2,5 molárního ekvivalentu aminu. Diazotace je popsána stechiometrickou rovnicí (obrázek 10-2).
![]()
Obrázek 10-2. Stechiometrická rovnice diazotace aromatického aminu
Výše uvedenou rovnici lze z hlediska mechanismu celé reakce rozepsat na více kroků. Prvním krokem je rozpuštění aminu ve vodě a vznik amoniové sole - jedná se o tzv. přímou diazotaci, kde dusitan ještě není přítomen (obrázek 10-3). Druhým krokem je vznik kyseliny dusité. Třetím krokem je vznik nitrosokationtu, lépe řečeno nitrosilačního činidla (NOX). Čtvrtým krokem je "nitrosace" aminu a vznik diazoniové sloučeniny.
![]()
![]()
![]()
![]()
Obrázek 10-3. Jednotlivé reakční stupně diazotace aromatického aminu
Během diazotace by pH roztoku nemělo být vyšší dvou (pH< 2). To má v podstatě dva důvody. Za prvé, při vyšším pH by v roztoku byl větší obsah "volné báze" (NH2), což by u aminů bez solubilizačních skupin mohlo vésti k jejich nekompletnímu rozpuštění v roztoku. Za druhé, nízká koncentrace vodíkových iontů a tím vyšší koncentrace volného aminu způsobí v průběhu diazotace vznik nežádoucího triazenu (obrázek 10-4).
![]()
Obrázek 10-4. Vznik triazenu
Při diazotacích slabě bázických aminů je za potřebí mnohem vyšší koncentrace vodíkového kationtu, než teoretických dvou ekvivalentů. Klasickým příkladem je diazotace p-nitroanilinu, kde se p-nitroanilin nejprve rozpustí v horké 5 - 10 M HCl a nalitím na led se vysráží ve formě amonium hydrochloridu (10.2)
![]()
Dříve než se stačí obnovit volná báze, provedeme rychlou diazotaci rychlým nalitím dusitanu sodného do roztoku.
Na rozdíl od kyseliny, dusitanu přidáváme přesný ekvivalent aminu, kdy diazotujeme do velmi mírného přebytku kyseliny dusité (cca 10-4 M). Konec diazotace, čili vznik přebytku kyseliny dusité, indikujeme kapkovou reakcí na jodoškrobovém papírku, kde HNO2 zoxiduje KJ na jod, který zbarví papírek impregnovaný škrobem na modro (obrázek 10-5).
![]()
Obrázek 10-5. Indikátorová reakce pro kontrolu přítomnosti kyseliny dusité
Pozor, zbarvení do modra musí být okamžité, protože také diazoniová sloučenina je po určitém čase schopna oxidovat jodid na jod.
Velký přebytek kyseliny dusité po skončení diazotace je škodlivý, protože kyselina dusitá může reagovat s diazoniovou sloučeninou za vzniku diazonitritu (Ar-N2-NO2). Detaily jsou diskutovány v kapitole pojednávající o homolytických dediazotacích.
Přebytek kyseliny dusité lze naštěstí odstranit přídavkem vhodného alifatického aminu (zde využíváme faktu, že diazoniové sloučeniny od alifatických uhlovodíků jsou nestálé - vzniká dusík). Všeobecně se pro odstranění HNO2 používá kyselina sulfamidová (NH2SO3H) nebo močovina (obrázek 10-6).

Obrázek 10-6. Způsob likvidace přebytečné kyseliny dusité
Jak ale ukázal Zollinger, reakce močoviny je pomalá a proto je lepší použít kyselinu sulfamidovou.
Jako doplňující informaci zde uvádíme, že diazotační reakce se využívá v analytické chemii ke stanovení obsahu aromatických aminů ve vzorcích (titrace dusitanem sodným).
Diazotace, jak jsme již uvedli, se provádí za nízkých teplot. To má dvě příčiny. Za prvé, při nižší teplotě stoupá rozpustnost plynu ve vodě, takže je menší nebezpečí uvolnění nitrosních plynů z reakční směsi. Za druhé, diazoniové sloučeniny jsou při nižších teplotách stabilnější. Jsou-li diazoniové sloučeniny dostatečně stabilní, lze diazotaci provádět i při vyšší teplotě - např. kyselina sulfanilová (HO3S-C6H4-NH2) se diazotuje při 10 - 15oC.
V průmyslu se (hlavně při diazotacích monoazosloučenin při výrobě disazosloučenin a polyazosloučenin) často diazotuje i při vyšších teplotách (30 - 40oC). Jako extrém uvádíme diazotaci 3-aminodibenzofuranu, která se provádí při 50oC (obrázek 10-7).

Obrázek 10-7. Diazotace 3-aminodibenzofuranu
Diazotace za vyšších teplot (t > 20oC) se mohou provádět pouze u velmi zředěných roztoků (koncentrace aminu a kyseliny musí být menší 1 mol/litr). Např. diazotace ve vysoce koncentrované kyselině sírové za vyšších teplot může s vysokou pravděpodobností vést k výbuchu.
Udržování teploty okolo 0oC v průběhu diazotace se nejlépe provádí přídavkem ledu do výchozí reakční směsi (diazotace je exotermní reakce). Toto chlazení je účinnější než chlazení externí.
Za vhodných kyselých podmínek (pH< 3) lze provést diazotaci sloučenin následujícího typu, aniž by došlo k hydroxy-deaminaci alifatického aminu.(obrázek 10-8).
![]()
Obrázek 10-8. Diazotace aromatického aminu majícího v postranním řetězci
alifatickou aminoskupinu
Je to způsobeno tím, že alifatický amin je mnohem bazičtější než aromatický (sp3 hybridizace) a tím pádem je "všechen" ve formě amoniové sole, která je nereaktivní vůči nitrosylovému kationtu.
4,4´-Diaminobifenyl (benzidin) je snadno didiazotovatelný (jedná se o tzv. tetrazotaci), kdy v prvním kroku je diazotována první aminoskupina a v druhém druhá (obrázek 10-9).
![]()
Obrázek 10-9 Diazotace benzidinu
Neplanarita obou fenylů (vytočení z roviny) ovšem způsobí, že pokud bychom přidali na 1 mol benzidinu 1 mol dusitanu, nedostali bychom monodiazoniový derivát, ale směs produktů. Je ale zajímavé, že smícháme-li 1:1 benzidin a bisdiazotovaný benzidin, získáme ve vodně kyselém prostředí (HCl/H2O) 4-amino-4´-diazonium bifenyl (utváří se přes triazenovou rovnováhu).
Deriváty aromatických aminů, které mají v molekule sulfoskupinu, existují v kyselých roztocích ve formě podvojných solí, které jsou v těchto roztocích málo rozpustné. Např. kyselina sulfanilová je monoprotonická (obrázek 10-10).

Obrázek 10-10. Acidobázická rovnováha kyseliny sulfanilové
Proto se tyto aromatické amino sulfokyseliny diazotují tzv. nepřímou diazotací, kdy se nejprve amin rozpustí přídavkem alkálie ve vodě, přidá se dusitan (pH roztoku musí být s jistotou mírně alkalické), ochladí se, a najednou přidá potřebné množství kyseliny.
Diazotace v suspenzi se také provádí tak, že se někdy přidávají dispergační činidla pro rychlejší průběh reakce.
Diazotace heterocyklických aminů je náročná operace. Zde je potřeba si uvědomit dvě fakta. Heterocykly se používají proto, abychom mohli vyrobit monoazobarviva hlubokých odstínů (violetě až modře), např. disperzní modř (10.3).

Monoazobarvivo je modré pouze za podmínky, že molekula je silně polarizována, t.j., že na jedné straně centrální azovazby je silný elektron-akceptor a na druhé elektron-donor. Silný akceptor (heterocyklus s nitroskupinou) pak znamená, že výchozí amin je velmi slabě bázický a tudíž špatně diazotovatelný (navíc to způsobí i špatnou rozpustnost takového aminu ve vodně kyselém prostředí). Druhým problémem je, že když už je takový slabý amin diazotován, tak příslušná diazoniová sloučenina je velmi nestálá, nebo-li velmi reaktivní, protože silný akceptor odtahuje elektrony a tím zvyšuje kladný náboj na diazoniové skupině. Tento druh diazoniových sloučenin se udrží stabilní pouze ve velmi kyselých prostředích. Proto se takové aminy diazotují výhradně v koncentrované kyselině sírové nitrosylsírovou kyselinou.
Zvýšit rozpustnost aminu a tím umožnit rychlejší diazotaci (a lepší výtěžek) je možné přídavkem organického rozpouštědla, kdy obvykle diazotačním činidlem je ester kyseliny dusité (ethyl nebo isopentyl nitrit).
Diazotujeme-li heterocyklické aminy, kde heteroatomem je dusík, hrozí nebezpečí, že tento dusík může být bázičtější než aminodusík. Důsledkem pak je, že vzniklá diazoniová sloučenina může reagovat s heterocyklickým dusíkem za vzniku triazenu. Tato následná reakce se potlačuje prací ve více kyselých prostředích (obrázek 10-11).
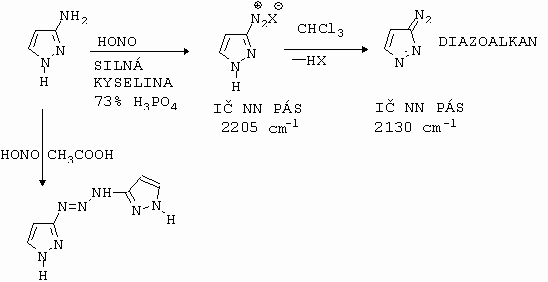
Obrázek 10-11. Diazotace 3-amino-1-H-pyrazolu
Výše uvedené schema je typické pro diazotaci většiny aminoazolů. Tvořené diazoniové sloučeniny jsou totiž relativně velmi silné kyseliny a tudíž je snadná deprotonace diazoniového iontu na diazosloučeninu. Reaktivita b -dusíku diazoskupiny je nižší (při elektrofilních aromatických substitucích, čili kopulacích) než u diazoniového kationtu (obrázek 10-12).

Obrázek 10-12. Deprotonace diazoniového iontu na diazosloučeninu
Diazotace slabých aminů se provádí, jak už bylo řečeno, v koncentrovaných minerálních kyselinách. Výzkum ukázal, že rychlost určujícím krokem celé diazotace je adice nitrosačního činidla na aromatickou (nebo heteroaromatickou) bázi (amin). Tudíž acidita pro diazotaci určitého aminu musí být zvolena tak, aby koncentrace volné báze (aminu) v roztoku (odpovídající příslušné rovnováze amin / amoniový kationt) odpovídala jejímu nasycenému roztoku (nasycený roztok aminu). Toto pravidlo pak vede k použití vyšších koncentrací minerální kyseliny pro diazotaci slabých aminů ve vodě.
Ve výše koncentrovaných kyselinách podléhá ovšem kyselina dusitá nežádoucím reakcím. V HCl, kde koncentrace HCl > 20 % dochází k následující nežádoucí oxidaci a tvorbě chloru (obrázek 10-13)
![]()
Obrázek 10-13. Nežádoucí reakce kyseliny dusité s HCl
Rovněž přidáváme-li roztok dusitanu sodného do roztoku H2SO4 nebo HNO3, kde koncentrace těchto kyselin je vyšší 25 %, potom vznik nitrosních plynů je rychlejší než nitrosace (vznik žlutých dýmů nad povrchem roztoku - nitrosní plyny jsou jedovaté). Nicméně diazotace lze hladce provádět v kyselině nitrosylsírové, kdy pevný dusitan sodný se rozpustí v 96 %ní H2SO4 při 0 - 10 oC za tvorby NO+ HSO4-. Nejlepší roztok je (stabilní) 1 M NaNO2 v 96 % H2SO4.
Ve vodných roztocích H2SO4 také dochází, jak už bylo ukázáno, k tvorbě nitrosylového kationtu, přičemž dochází k tvorbě intermediátu H2O+-NO. (obrázek 10-14).
![]()
Obrázek 10-14. Tvorba nitrosylového kationtu působením kyseliny sírové
V závislosti na aciditě dochází k rozkladu kyseliny nitrosylsírové. Nám postačí vědět, že při koncentraci 64 % H2SO4 klesá tato rychlost rozkladu k nule. Naopak maximální rychlost rozkladu je tehdy, je-li koncentrace HNO2 rovna koncentraci
H2O+-NO (obrázek 10-15).

Obrázek 10-15. Rozklad kyseliny dusité za vzniku nitrosních plynů
Prakticky se diazotace nitrosylsírovou kyselinou provádí tak, že se rozpustí amin v 96 %ní H2SO4 a přikape se 1 M roztok nitrosylsírové kyseliny v 96 %ní H2SO4. Teplota je obvykle 20 - 25 oC. V současnosti se pro diazotace heterocyklických aminů používá nitrosylsírová kyselina ve směsi s kyselinou octovou a propionovou, které zvýší rozpustnost aminu v systému.
Při diazotacích slabých aminů se nesmí zapomenout na již dříve zmíněný fakt, že diazoniové sloučeniny těchto aminů jsou stále pouze ve velmi kyselých prostředích. Jedná se např. o již dříve zmiňovaný p-nitroanilin a ještě více aminy heterocyklické. Dekompozice diazoniové sloučeniny se může projevit i v kolpulačních systémech (proto se kopulace provadí obvykle za chladu).
Zvláštní kapitolou jsou diazotace o-diaminů, takových jako je o-fenylendiamin (obrázek 10-16).

Obrázek 10-16. Diazotace o-fenylendiaminu
Vidíme, že podle podmínek diazotace dostaneme buď bis-diazoniovou sloučeninu a nebo 1,2,3-benzotriazol. Tvorba triazolu je intramolekulární N-kopulace.
10.2.1 Izolace diazoniových solí
Normálně se diazoniové sloučeniny neizolují a to z několika důvodů, které uvedeme později. Z hlediska čistoty by bylo výhodné diazoniové soli izolovat, ale u většiny z nich hrozí nebezpečí výbuchu. Dále pak diazoniové sloučeniny jsou obvykle velmi dobře rozpustné ve vodě, což jejich izolaci ztěžuje, jelikož nelze roztok zahuš»ovat (stabilita, výbuch).
Nejstarší metoda získání tuhých diazoniových solí je provést diazotaci v ethanolu a posléze vysrážení etherem. Jako diazotační činidlo se v ethanolu používá ethyl nebo isopentylnitrit.
Další metodou je vysrážení diazoniové sole ve formě tetrafluoroborátu (ArN2+BF4-) nebo hexafluorofosfátu (ArN2+PF6-).
Jinou skupinou stabilních diazoniových solí jsou podvojné diazoniové sole kovu. Převážně se používá ZnCl2. Termín podvojná sůl je ale v tomto případě špatný, protože se ve skutečnosti jedná o komplex dvou diazoniových iontů s aniontem ZnCl42- ( (ArN2)2ZnCl4 ). Stabilita těchto komplexů je dána tím, že ZnCl42- aniont je mnohem méně nukleofilní než Cl- iont. Jak ukážeme později, dediazotace diazoniových solí může být buď hetero- nebo homolytická. Homolytická dediazotace je založena na přenosu elektronu z vhodného donoru. V pevné fázi proto rozklad diazoniové sole závisí na vlastnostech t.j. bazicitě aniontu (rovněž BF4- a PF6- jsou mnohem méně bazické než Cl-).
V průmyslovém měřítku se při výrobě azobarviv izolují (kvůli čistotě) diazoniové sločeniny mající ve své molekule sulfoskupinu. Je to proto, že tyto sole jsou málo rozpustné ve vodě a lze je tudíž snadno odfiltrovat. Navíc jsou dostatečně stabilní (pozor- pasta diazoniové sole se nesmí sušit). Stabilita těchto solí je způsobena vznikem diazosulfonátu (..-ArN2-OSO2-Ar-...).
10.2.2 Diazotace 2- a 4-aminofenolů
V prvé řadě diazoniovou sloučeninu obsahující ionizovanou hydroxylovou skupinu -O- můžeme napsat ve dvou mezomerních strukturách (obrázek 10-17).
![]()
Obrázek 10-17. Mesomerie diazoniové sloučeniny obsahující ionizovanou
hydroxylovou skupinu
Nazývají se chinondiazidy a nebo diazoniofenoláty (v tomto případě 4-diazo- niofenolát). Produkt diazotace o- a p-aminofenolů existuje proto v neutrálních vodných prostředích jako podvojný iont (obrázek 10-18).

Obrázek 10-18. Diazotace pikraminové kyseliny
Hlavním problémem těchto diazotací je oxidace výchozích aminofenolů kyselinou dusitou na příslušné chinoniminy. Tyto jsou proto diazotovány v slabě kyselých prostředích (pH ~ 3, tzv. neutrální diazotace) nebo v přítomnosti solí zinku či mědi. Mechanismus katalýzy ale není jasný. o-Aminofenoly jsou důležité pro výrobu kovokomplexních azobarviv.
Občas se provádí diazotace těchto látek v koncentrované kyselině sírové. Takto lze získat bisdiazoniovou sůl, která se ale deprotonuje na chinondiazid (obrázek 10-19).
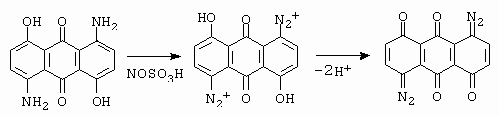
Obrázek 10-19. Diazotace 1,5-diamino-4,8-dihydroxyanthrachinonu
Chinondiazid je tak stabilní sloučenina, že např. diazotací 2-aminofenazinu se rychlou následnou oxidací vzduchem vytvoří chinondiazid (obrázek 10-20).
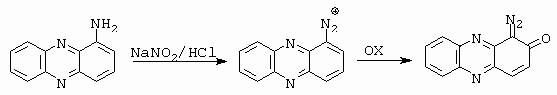
Obrázek 10-20. Diazotace 2-aminofenazinu
Toto je ovšem velmi výjimečný případ. Méně výjimečný je případ, kdy v důsledku toho, že diazoniová skupina má velmi silný -M a -I efekt, nastane jev, kdy halogen na jádře se stane snadno odstupující nukleofilní skupinou a je substituován skupinou OH za tvorby chinondiazidu a nebo dojde k dediazotaci (obrázek 10-21).
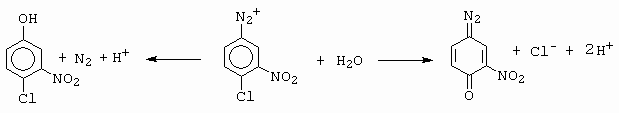
Obrázek 10-21. Následné reakce 3-nitro-4-chlorbenzendiazoniové sloučeniny
Jako poznámku zde uvádíme, že chinondiazid je schopen rovněž kopulační reakce (ale reaguje dosti pomalu). Rovněž vysoká stabilita přispívá k tomu, že chinondiazidy se izolují filtrací a v suché formě prodávají. Klasickým příkladem je polotovar pro syntézu kovokomplexních černí (10.4).
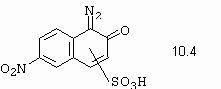
Dalšími příklady vzniku chinonových struktur je diazotace sulfamidu (obrázek 10-22), nebo diazotace 4-aminofenylmalonitrilu (obrázek 10-23).
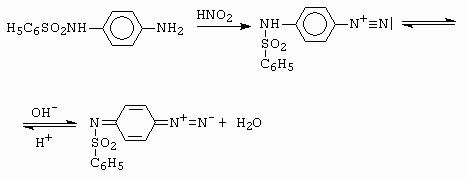
Obrázek 10-22. Diazotace N-(p-aminofenyl)-benzensulfonamidu
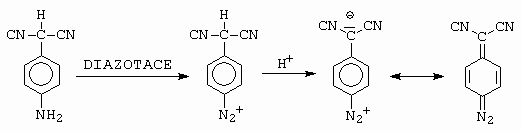
Obrázek 10-23. Diazotace 4-aminofenylmalonitrilu