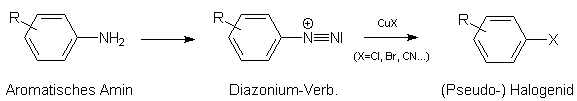
Chemikalien-Lexikon: Namensreaktionen
SANDMEYER-Reaktionen 1)
1) Traugott SANDMEYER (1854 - 1922), geboren in Wettingen im Aargau (Schweiz), Industriechemiker bei der Firma I.R.Geigy AG in Basel. Assistent von V. MEYER und HANTZSCH. Beschäftigte sich v.a. mit Diazoniumsalzen, Thiophen, den Triphenylmethan-Farbstoffen sowie der Isatin- und Indigo-Synthese.
Mit dieser im Jahre 1884 von SANDMEYER gefundenen Methode lassen sich an aromatischen Kernen befindliche Aminogruppen durch Halogene (vor allem Cl, Br; Fluor geht nicht) und Pseudohalogene (z.B. CN, SCN) ersetzen. Dabei wird die Aminofunktion zunächst in eine Diazonium-Gruppe umgewandelt (sog. Diazotierung). Die so gebildete Diazonium-Verbindung wird einer Umsetzung mit Kupfer(I)-halogenid unterworfen:
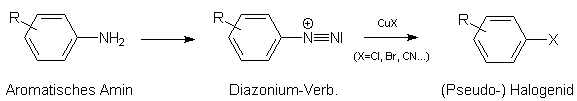
Es ist damit aus einem aromatischen Amin (Arylamin) ein Arylhalogenid (bzw. -pseudohalogenid) entstanden.
Man kann auch von aromatischen Verbindungen mit Nitrogruppe ausgehen. Diese muß man vor der Diazotierung zum aromatischen Amin reduzieren.
Vorgehensweise
Das aromatische Amin wird (in salzsaurer Lösung und unter Eiskühlung; alternativ dazu wird bei der Darstellung von Arylbromiden auch Bromwasserstoff- oder Schwefelsäure eingesetzt) mit Natriumnitrit diazotiert. Nunmehr fügt man eine Lösung des gewünschten Kupfer(I)-salzes (Kupferchlorid, -bromid, cyanid* usw.) in Salzsäure hinzu. Man benötigt dabei ein Äquivalent der Kupferverbindung (also nicht nur katalytische Mengen). Es bildet sich ein braun gefärbter, kaum löslicher Komplex aus Diazoniumverbindung und Kupfer(I)-halogenid. Beim Erwärmen dieser Komplexverbindung auf dem siedenden Wasserbad zerfällt sie unter Entwicklung von Stickstoff. Die bisher feste Abscheidung wird bei dem Vorgang gelöst, und das aromatische Halogenid erscheint im Reaktionsgefäß als ölige Schicht. Die Reinigung des Endproduktes bedarf besonderer Sorgfalt; in der Regel ist zur Trennung von den organischen Nebenprodukten (wie z.B. Diaryle, Phenole, Azoverbindungen) und den anorganischen Bestandteilen eine Wasserdampfdestillation notwendig.
Zweckmäßigerweise führt man SANDMEYER-Umsetzungen gleich in Reaktionsgefäßen durch, die für eine nachfolgende Wasserdampfdestillation geeignet sind. Flüssige Reaktionsprodukte werden aus dem Wasserdampfdestillat mit Diethylether extrahiert; nach dem Waschen der vereinigten Etherextrakte (zunächst mit Natriumhydroxidlösung 2 M und dann mit Wasser) und anschließendem Trocknen wird nochmals destilliert. Feste Endprodukte können abgenutscht und durch Umkristallisieren aufgearbeitet werden.
* Das als Katalysator fungierende Kupfer(I)-salz kann durch Umsetzung von Kupfer(II)-sulfat mit Natriumchlorid bzw. Natriumbromid in Anwesenheit von Natriumsulfit als Reduktionsmittel auch selbst hergestellt werden.
Mechanismus
Man vermutet, daß die Diazonium-Verbindung reduziert wird (dabei gleichzeitig Cu+I zu Cu+II oxidiert); unter Abspaltung von Stickstoff entsteht dabei ein Aryl-Radikal. Dieses verbindet sich mit dem Halogenid-Anion des zugesetzten Kupfersalzes, wobei eine gleichzeitige Reduktion von Cu+II zu Cu+I stattfindet. Die Verhältnisse verdeutlicht das folgende Schema:
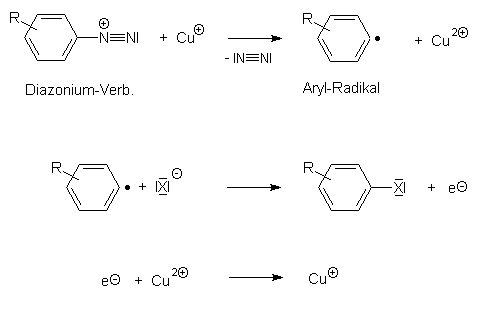
Man verdeutliche sich nochmals die Begriffe:
Oxidation = Elektronenabgabe bzw. -entzug
(Oxidationsmittel = Elektronenakzeptor, z.B. Cu+II)
Reduktion = Elektronenaufnahme bzw. -zufuhr (Reduktionsmittel =
Elektronendonator, z.B. Cu+I)
Anwendungen
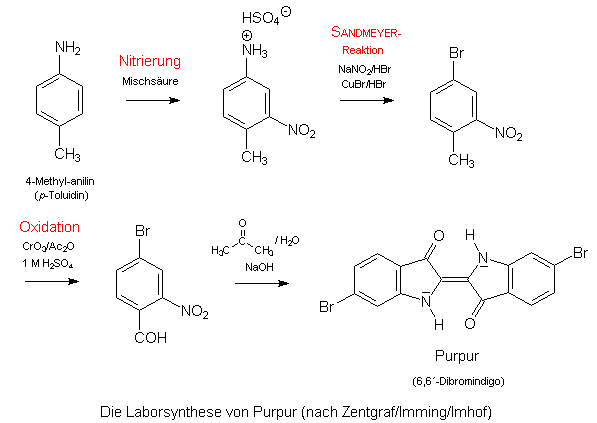
Eine interessante praktische Verwendung der SANDMEYER-Reaktion ist der Ersatz der Aminogruppe im 4-Methyl-3-nitroanilin durch Brom. Diese Verbindung ist ein wichtiges Zwischenprodukt bei der Laborsynthese des wertvollen violetten Farbstoffs Purpur. 4-Methyl-3-nitroanilin (= 4-Methyl-3-nitrophenamin) ist zugänglich durch Nitrierung von p-Toluidin:
Erstellt am 26.04.2000 * Letzte Änderung am 26.04.2000