Chemikalien-Lexikon: Namensreaktionen
LEUCKART1)-WALLACH2)-Reaktion
1)
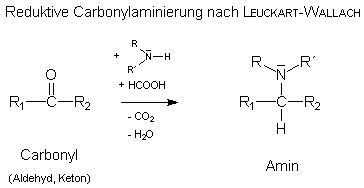
Rudolf LEUCKART (1854-1889), geb. in Gießen, Dissertation zu Leipzig bei Kolbe, wirkte an der Universität Göttingen.Diese Umsetzung ist eine wichtige Möglichkeit zur Darstellung von Aminen (vor allem tertiärer Amine).
Ausgehend von einem primären oder sekundären Amin (R-NH2 oder R-NH-R´), in besonderen Fällen auch von Ammoniak (NH3) entstehen mit Carbonylverbindungen (Aldehyden oder Ketonen) unter Zuhilfenahme von Ameisensäure als Reduktionsmittel alkylierte Amine:

Setzt man den reaktionsfähigen Formaldehyd als Carbonylkomponente ein (R1=R2=H), so lassen sich die eingesetzten Amine in aufeinanderfolgenden LEUCKART-WALLACH-Reaktionen vollständig methylieren. Auf diese Weise entsteht z.B. aus dem primären Amin 1-Butylamin das tertiäre Amin N,N-Dimethyl-butylamin:
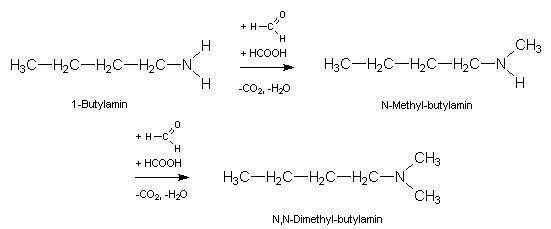
Die Isolierung des zwischenzeitlich entstehenden, einfach methylierten N-Methyl-butylamins (= N-Butyl-methylamin) ist nicht möglich, da es mit Formaldehyd gleich weiterreagiert. Die mit Formaldehyd durchgeführte und zur Amin-Methylierung führende Variante der L.-W.-Reaktion bezeichnet man als ESCHWEILER-Reaktion.
Auch mit den weniger reaktionsfähigen Carbonylverbindungen entstehen höher alkylierte Amine als Begleitprodukte, sodaß die geschilderte Methode - von Ausnahmen abgesehen - nicht zur Darstellung primärer oder sekundärer Amine verwendet wird.
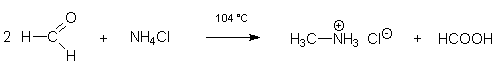
Eine der Ausnahmen bildet die Darstellung von Methylamin-hydrochlorid (= Methylammoniumchlorid) durch Erwärmen einer Mischung von Formaldehyd-Lösung (Formalin) mit Ammoniumchlorid in einer Ausbeute von 45-51%. Hierbei fungiert der Formaldehyd gleichzeitig als Carbonylkomponente und als Reduktionsmittel; er wird dabei zur Ameisensäure oxidiert!
Arbeitet man dagegen mit festem Paraldehyd bei höherer Temperatur (ca. 160 °C), so führt die Umsetzung zum Trimethylamin-hydrochlorid, mithin zum tertiären Amin.
Mechanismus
Amine können - wie Ammoniak - als Stickstoffbasen Carbonylgruppen nucleophil angreifen. Über einen zwitterionischen Zwischenzustand bildet sich ein unbeständiges Additionsprodukt (sog. Halbaminal), welches nach Protonierung und nachfolgender Wasserabspaltung in ein Carbenium-Immonium-Kation übergeht:
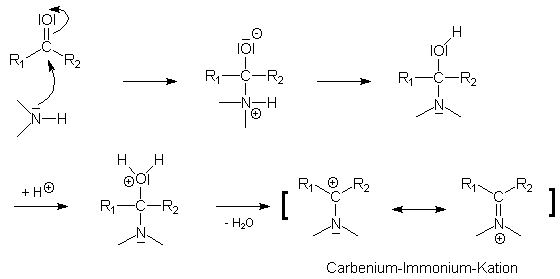
Dieses Gebilde vermag nun durch Ameisensäure angegriffen zu werden. Es bildet sich ein cyclischer Übergangszustand, der wie folgt formuliert werden kann:
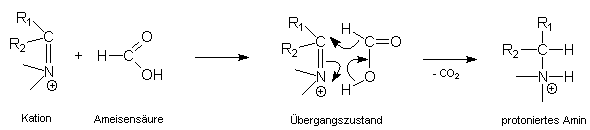
Die Ameisensäure wird dabei zu Kohlenstoffdioxid oxidiert, das Kation dagegen reduziert. Diese reduktive Carbonyl-Aminierung nach LEUCKART-WALLACH führt damit zum selben Ergebnis wie die katalytische reduktive Aminierung von Aldehyden und Ketonen, allerdings unter wesentlich einfacheren Bedingungen (kein Autoklav notwendig!) und mit dem Vorzug, auch solche Reaktionspartner einsetzen zu können, die sonst den Hydrierkatalysator vergiften würden.
Man arbeitet stets mit einem Überschuß an Ameisensäure (Für jedes Mol der Carbonylverbindung werden 2 bis 4 Mol Ameisensäure eingesetzt). Bei Verwendung von Formaldehyd als Carbonylkomponente kann in wäßriger Lösung gearbeitet werden, demzufolge reicht handelsübliche 85%ige Ameisensäure aus. Dagegen ist die Anwesenheit von Wasser bei der Umsetzung weniger reaktionsfähiger Carbonylverbindungen unerwünscht (vermindert die Ausbeute). Man nimmt hier konzentrierte, mind. 98%ige Ameisensäure und trennt entstehendes Wasser destillativ ab.
Eine Besonderheit stellt die Herstellung primärer Amine mit Hilfe von Ammoniumformiat, dem Ammoniumsalz der Ameisensäure, dar. In diesem Stoff ist die Aminkomponente (Sonderfall: NH3!) und die Ameisensäure in einem Stoff vereinigt. Das Ammoniumformiat dissoziiert nämlich beim Erwärmen (wie alle Ammoniumsalze), und zwar in Ammoniak und Ameisensäure.
Mit Ketonen lassen sich so primäre Amine herstellen, beispielsweise a-Phenylethylamin aus Acetophenon:

Setzt man hierbei Ketone ein, die am Benzolkern Halogen- oder Nitrogruppen aufweisen, so werden diese unter den bei der LEUCKART-WALLACH-Reaktion herrschenden Bedingungen nicht angegriffen.
Es gibt Abwandlungen der LEUCKART-WALLACH-Reaktion, bei denen anstelle der Ameisensäure andere Reduktionsmittel verwendet werden:
Weiterhin können auch (substituierte) Formamide in die Reaktion eingebracht werden:
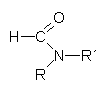
Literaturhinweise/Quellenangaben:
BEYER/WALTER, Lehrbuch der organischen Chemie 19. Aufl., S. 491 (S. Hirzel, Stuttgart 1981) - Reduktive Carbonylaminierung von Acetophenon
Bull. Chem. Soc. Jpn. 49, 2485 (1976)
FIESER Louis und Mary, Organische Chemie 2. Aufl., S. 600 (Verlag Chemie, Weinheim 1979) - Reduktive Aminierung nach LEUCKART, 1885
FOX/WHITESELL, Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen, S. 472f (Spektrum Akademischer Verlag, Heidelberg 1995) - Addition von Stickstoffnucleophilen, Bildung von Immonium-Ionen
INGERSOLL A.W., in: Organic Syntheses, Collective Volume 2 (ed. by A.H. BLATT), p. 503ff (J. Wiley & Sons, New York 1943) - Darstellung von a-Phenylethylamin, Arbeitsvorschrift
Organikum, Organisch-chemisches Grundpraktikum, 20. Aufl., S. 534 (Wiley-VCH, Weinheim und New York 1999) - Mechanismus der L.-W.-Reaktion, Arbeitsvorschriften
RÖMPP Chemielexikon (Hrsg. Falbe/Regitz), 9. Aufl. Bd. 3 H-L , Seite 2491f (Georg Thieme Verlag, Stuttgart 1995) - Eintrag LEUCKART-Reaktionen
Tetrahedron 19, 1789 (1963)
Tetrahedron Lett. 23, 779 (1982)
Internet-Ressourcen:
SCHLEIFENBAUM Andreas, Leuckart-Wallach-Reaktion
Die im vorliegenden Chemikalien-Lexikon enthaltenen Informationen dienen zu wissenschaftlichen Schulungszwecken. Sie sind nicht dazu bestimmt, irgendwelche Eigenschaften von Produkten oder deren Eignung für einen bestimmten Verwendungszweck zuzusichern. Die Benutzung der Informationen geschieht auf vollkommen eigene Verantwortung des Lesers. Jegliche Haftung für Schäden, Folgeschäden oder Verluste, die beim Umgang mit den hierin beschriebenen Stoffen oder Zubereitungen oder bei der Durchführung der im Lexikon enthaltenen chemischen Versuchsbeschreibungen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Mit dem Abrufen und Benutzen der Daten erkennt der Benutzer diese Bedingungen an.
Es wird ausdrücklich darauf hingewiesen, daß für den Umgang mit Gefahrstoffen zahlreiche gesetzliche Regelungen und Einschränkungen gelten. Chemikalien dürfen nur von Personen mit der erforderlichen theoretischen und praktischen Sachkenntnis unter Einhaltung aller national gültigen Vorschriften gelagert und verwendet werden. Die dem jeweiligen Stand der chemischen Wissenschaft und Technik entsprechenden Sicherheitsvorkehrungen, Unfallverhütungsrichtlinien und Maßnahmen zur Arbeitshygiene sind ebenfalls einzuhalten.
Erstellt am 16.04.2000 * Letzte Änderung am 29.07.2000