Chemikalien-Lexikon: Namensreaktionen
KNOEVENAGEL 1) -Reaktion (1898)
1) Emil KNOEVENAGEL (1865 - 1921), Geburtsort Linden bei Hannover. Dissertation in Göttingen, wirkte an der Universität Heidelberg (Ruperto-Carola).
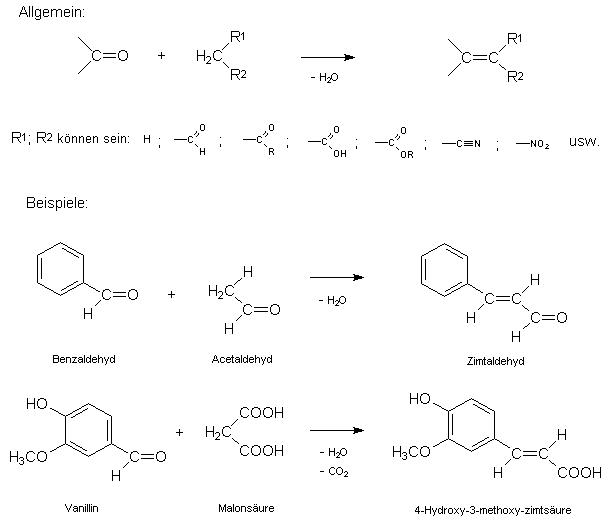
Die Knoevenagel-Reaktion ist eine besondere Abart der Aldol-Reaktion mit nachfolgender Kondensation (Wasserabspaltung). Die Methode dient besonders zur Kettenverlängerung aromatischer (und damit nicht enolisierbarer) Aldehyde. Ein Beispiel ist die Bildung von Zimtaldehyd aus Benzaldehyd und Acetaldehyd.
Bringt man aromatische (oder manche aliphatische) Aldehyde bzw. Ketone in Anwesenheit einer Base mit Verbindungen hoher C-H-Acidität zusammen, die am Methylenkohlenstoffatom eine Carbonyl-, Nitril- oder Nitrogruppe aufweisen (sog. "Methylenkomponenten"), so bildet sich zunächst ein Aldol (Name von Aldehyd und Alkohol!). Dieses vermag sich unter Wasserabspaltung und Ausbildung einer C=C - Doppelbindung zu stabilisieren. In manchen Fällen (z.B. bei Verwendung von Malonsäure als Methylenkomponente) kann begleitend auch eine Decarboxylierung (= Abspaltung von Kohlenstoffdioxid) auftreten.

Die Umsetzung ist präparativ sehr wertvoll. Je nach eingesetzter C-H-acider Komponente lassen sich nach KNOEVENAGEL Aldehyde, Carbonsäuren und -ester, Nitrile oder Nitroverbindungen herstellen.
Mechanismus:
Im ersten Schritt entreißt die katalysierende Base (Knoevenagel verwendete Ammoniak und primäre oder sekundäre Amine) der Methylenkomponente ein Proton. Es bildet sich ein mesomerie-stabilisiertes Enolat-Anion:

Das Enolat-Anion stellt ein Nucleophil dar, welches die eingesetzte (nicht enolisierbare!) Carbonylverbindung im zweiten Schritt der Reaktion angreifen kann. Formuliert sei die Anlagerung an Benzaldehyd.

Aus Enolat-Anion und Benzaldehyd bildet sich ein stark basisches Alkoholat-Ion, welches durch Aufnahme eines Protons (von der protonierten Base B-H oder auch vom Lösungsmittel) in ein gemischtes Aldol übergeht ("gemischt" deshalb, weil die Aldolbildung aus zwei verschiedenen Carbonylpartnern erfolgte). Wie jedes andere Carbonyl auch kann das Aldol enolisieren. Die Eliminierung eines Wassermoleküls kann durch eine intramolekulare Reaktion aus einem sechsgliedrigen Übergangszustand des Enols heraus erklärt werden (siehe Formelschema).
| Ausgangsverbindung
A (Aldehyd, Keton) |
Ausgangsverbindung
B (Methylenkomponente) |
Endprodukt |
| Benzaldehyd | Acetaldehyd | Zimtaldehyd |
| Benzaldehyd | n-Heptanal | Jasminaldehyd |
| Benzaldehyd | Malonsäure | Zimtsäure |
| Benzaldehyd | Malonsäure-diethylester | Benzylidenmalonsäure- diethylester |
| Crotonaldehyd | Malonsäure | Sorbinsäure |
| Vanillin | Malonsäure | Ferulasäure |
Literaturhinweise/Quellenverzeichnis:
Organikum, Organisch-Chemisches Grundpraktikum, 20. Aufl., S. 501f (Wiley-VCH Verlag GmbH, Weinheim * New York 1999)
Erstellt am 04.08.2000 * Letzte Änderung am 04.08.2000