
Hans Theodor Bucherer (1869 - 1949)
Nach der Emeritierung von Schultz wird Hans Bucherer sein
Nachfolger in der Chemischen Technologie.
Hans Theodor Bucherer
studiert in München, Karlsruhe und Leipzig Chemie und promoviert dort im
Jahr 1893 bei Wislicenus "Über einige Derivate des
Keto-Hexens des Ketons der a-Pimelinsäure".
Nach einer
Industrietätigkeit bei der BASF in Ludwigshafen wird er 1901 Privatdozent
an der Technischen Hochschule Dresden, wo er Farbenchemie lehrt. Im Jahr
1913 wird Bucherer an die Technischen Hochschule Berlin und 1926 als
Professor für Chemische Technologie hierher an die Technische Hochschule
München berufen. Daneben ist er von 1908 bis 1911 bei der Firma Kalle
& Co. AG in Biebrich als Laborvorstand und Prokurist tätig. Von 1913
bis 1916 ist er ordentliches Mitglied des Vorstands der Chemischen Fabrik
auf Aktien in Berlin (Schering AG). Auch nach der, aus seiner Sicht viel
zu früh aufgedrängten Emeritierung im Jahre 1934 setzt er seine
wissenschaftlichen Arbeiten fort.
Bucherer interessiert sich vor allem
für die Chemie aromatischer Diazoniumsalze und ihre Verwendung bei der
Herstellung von Farbstoffen. So schreibt er
mehrere Lehrbücher der Farbenchemie, bemüht sich besonders um die
Übertragung von Laborergebnissen in die industrielle Anwendung und ist
häufig als Gutachter bei Patentstreitigkeiten tätig.
Aus Bucherers
Arbeiten sind vor allem drei Reaktionen bekannt geblieben:
Mit der
Bucherer-Reaktion lassen sich Phenole in der
Naphthalin-, Anthracen- und Phenanthrenreihe mittels
Ammoniumhydrogensulfit in die entsprechenden Amine überführen. Bei
geeigneter Wahl der Bedingungen läßt sich die Reaktion auch in der
entgegengesetzten Richtung führen.

Bucherer erkennt die Reversibilität dieser bereits früher von
Lepetit beschriebenen Reaktion und macht sie für die
Farbstoffchemie nutzbar. Die Reaktion hat in der industriellen
Farbstoffchemie Bedeutung für die Synthese von Diazonium- und
Kupplungskomponenten, womit die Vielfalt der zugänglichen Farbstoffe stark
erweitert wird.
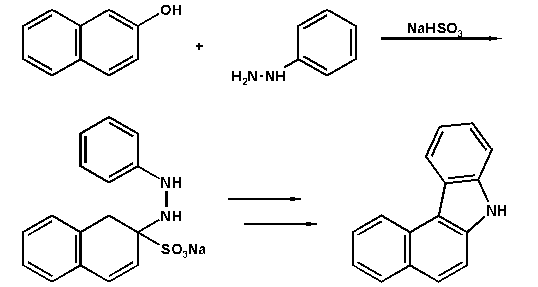
In einer verwandten Reaktion lassen sich durch Erhitzen
von Arylhydrazin und Natriumhydrogensulfit mit Naphtholen oder
Naphthylaminen Carbazolderivate darstellen.
Die Bucherer-Bergs-Reaktion (BB-4CC) ist eine Vier-Komponenten-Reaktion von Carbonylverbindungen mit Cyaniden und Ammoniumcarbonat zu Hydantoinen. Diese kristallisieren gemeinhin sehr gut und lassen sich durch heiße Mineralsäure zu Aminosäuren hydrolysieren.
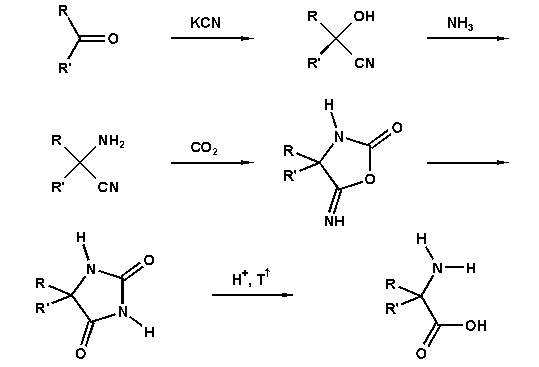
Diese Reaktion bildet damit die Grundlage einer wichtigen industriellen Synthese von (razemischen) Aminosäuren.