
Funkční barviva
Organická barviva jsou oborem, který v poslední době prochází obdobím převratných změn. Vedle "klasických" textilních barviv a pigmentů se stále více rozvíjí tzv. barviva funkční. Jedná se o barviva, která vedle své barevnosti vykonávají ještě nějakou fotofyzikální či fotochemickou funkci. Následující kapitoly proberou jednotlivé třídy funkčních barviv, kde dělení do tříd je z hledika jejich použití. Přehled rozhodně není vyčerpávající, a je kladen důraz na princip jejich funkce, strukturu a syntézu těchto barviv, tak, aby čtenář pochopil, o jaké oblasti barvářské organické chemie se jedná a jaké jsou nezbytné polotovary pro jejich syntézu.
14.1 Barviva pro fotografii a záznamová média
14.1.1 Barviva jako senzibilizátory pro klasi
ckou stříbrnou fotografiiNa klasickém černo-bílém filmu jsou emulze AgCl a AgBr. Tyto emulze ovšem reagují na světlo, které pro AgCl má vlnovou délku menší než 400 nm a pro AgBr menší než 500 nm. Mechanismus fotografické citlivosti je ukázán na obrázku 14-1, kde h
+ značí kladnou díru.
Obrázek 14-1. Princip fotochemické reakce AgBr emulze
Abychom získali černo-bílý obrázek našeho barevného světa (380 - 780 nm), musíme rozšířit citlivost až do 780 nm. To zajistí barvivo, které absorbuje energii (foton) a následně tuto energii předá AgX krystalu. Existují dva mechanismy tohoto přenosu energie.
První mechanismus je, že excitační energie je předána AgX za vzniku fotoelektronu ve vodivostním pásu halogenidu stříbra. Tento elektron redukuje Ag
+ na Ag0 (vzniká tzv. latentní obrázek). Tyto atomy stříbra, které jsou ve formě agregátů, jsou posléze katalyzátorem pro (vývojku) vyvinutí černo-bílé (také i barevné) fotografie.Princip spektrální senzibilace je ukázán na následujícím obrázku 14-2.
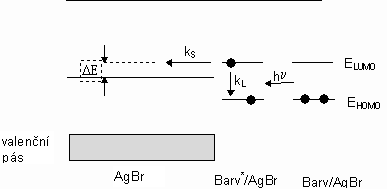
Obrázek 14-2. Mechanismus spektrální senzibilace AgBr
Účinnost senzibilace (f
r) je dána podílem f r = kS/(kS + kL). Rozdíl energie D E udává energii pro přenos elektronu.Druhý mechanismus je takový, že elektron z excitovaného stavu barviva tunelovým efektem prochází skrz energetickou bariéru mezi iontem barviva a povrchem krystalu AgX.
Oba mechanismy lze rozlišit, umístíme-li ionty senzibilizátoru do přesně definované vzdálenosti od povrchu AgX krystalu. Tato vzdálenost je přesně nastavena pomocí n-alkylového řetězce (R) v molekule senzibilizátoru. Jako senzibilizátory se používají převážně symetrické cyaniny, obecného vzorce (14.1), kde následující tabulka 14-1 udává rozsahy senzibilace pro jednotlivé heteroc
ykly:

Tabulka 14-1.
Heterocykly používané pro senzibilaci AgX emulzí|
Heterocyklus |
Y |
n |
Rozsah citlivosti (nm) |
|
benzothiazol |
S |
2 |
400-500 |
|
benzoxazol |
O |
3 |
500-600 |
|
benzimidazol |
N-R |
3 |
500-600 |
|
benzthiazol |
S |
3 |
600-700 |
|
benzselenazol |
Se |
3 |
600-700 |
|
benzthiazol |
S |
4-6 |
700-1300 |
14.1.2 Barviva v klasické barevné fotografii
Barviva se používají nejen pro senzibilaci, ale také pro vytvoření barevného obrázku. Klasická barevná fotografie (film) se skládá z podložky (vybavené anihilační vrstvou) a 4 vrstev (obrázek 14-3).

Obrázek 14-3. Jednotlivé vrstvy barevného filmu
Tři vrstvy, ve kterých probíhá fotochemická reakce obsahují potřebné senzibilizátory, pasivní komponenty a AgX. Působením světla, které projde do příslušné vrstvy je opět Ag
+ redukováno na Ag0. Osvětlený film se posléze ve vodní lázni "vyvíjí" vývojkou. Dříve to byl N,N-diethyl-p-fenylendiamin, ale protože vzniklá barviva byla málo světlostálá a snadno difundovala z jedné vrstvy do druhé, tak byly vyvinuty vývojky nové. Dnes je např. nejpoužívanější Kodak Developer CD3 (14.2).
Platí, že několik málo stříbrných agregátů vzniklých fotochemickou redukcí katalyzuje redukci halogenidu stříbra na stříbro, přičemž 5-10 fotonů je dostatečných pro vznik latentního obrazu v jednom zrnku (krystalu) AgX. To odpovídá zesilujícímu faktoru (multiplikační faktor) většímu 10
8. V průběhu vyvíjení je naopak vývojka oxidována na chinondiiminový iont (obrázek 14-4).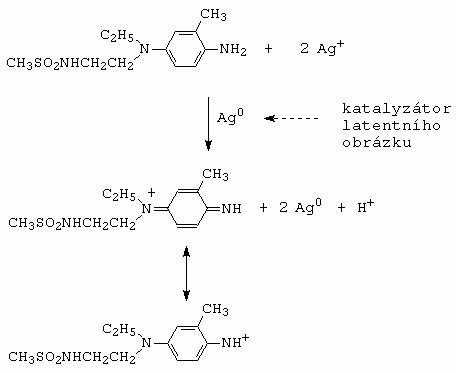
Obrázek 14-4. Oxidace vývojky
Chinoniminový kationt potom reaguje s příslušnou kopulační komponentou za vzniku azomethinového barviva. Celková rovnice vzniku např. žlutého barviva je na obrázku 14-5.

Obrázek 14-5.
Vznik žlutého azomethinového barvivaStejným způsobem vznikají i obě další barviva (obrázek 14-6).

Obrázek 14-6. Vznik purpurového a azurového azomethinového barviva
Následně, jsou-li již barviva vyvolána, reoxiduje se Ag na Ag
+ pomocí K3Fe(CN)6 a Ag+ ionty jsou odstraněny v další lázni thiosulfátem (S2O32-), který tvoří s Ag+ ve vodě rozpustné 1:2 a 1:3 komplexy.Tímto způsobem se získá negativ, ze kterého osvětlením vzniká pozitiv.
Hlavním problémem výrobců filmů byla difuze kopulačních komponent z jedné vrstvy do druhé. To bylo vyřešeno dlouhým alifatickým řetězcem, např. R
3 = C17H35. Jednotlivé barvotvorné pasivní komponenty dnes mají následující konstituci (obrázek 14-7).
Obrázek 14-7. Pasivní komponenty v barevné fotografii
1.3 Infračervená fotografie
Aby fotografický film byl citlivý na infračervené záření, musí být do fotografické emulze přidán fotosenzibilizátor (infračervené barvivo), který umožní vznik elektronu ve vodivostním pásu krystalu AgBr absorpcí infračerveného fotonu.
První IČ senzibilizátor připravil v roce 1904 Homolka, a jednalo
se pinacyanol (14.3), který má citlivost do 700 nm.
Od té doby byla připravena celá řada IČ senzibilizátorů, jejichž spektrální citlivost zasahuje mnohem dále. Např. následující pentakarbocyanin (14.4) má citlivost až do 1200 nm.

Problém je ale v tom, že s rostoucím polymethinovým řetězcem dochází nejen k bathochromnímu posunu, ale velmi klesá fotostabilita těchto barviv a také velmi klesá účinnost senzibilizace, jak dokladuje následující tabulk
a 14-2.Tabulka 14-2.
Vliv délky polymethinového řetězce na vlastnosti IČ barviva|
| ||
|
n |
l max (nm) |
f r |
|
0 |
425 |
0.74 |
|
1 |
560 |
0.11-0.27 |
|
2 |
655 |
0.02 |
|
3 |
760 |
0.02 |
|
4 |
870 |
|
|
5 |
995 |
|
Vyřešení těchto problémů přinesl objev "stabilizovaných" pentakarbocyaninů (14.5), které vykazují podstatně lepší fotostálost a mnohem vyšší účinnost spektrální senzibilizace.

Vrstvy infračerveného filmu ukazuje obrázek 14-8.

Obrázek 14-8.
Vrstvy infračerveného filmuZ
předešlého výkladu optických senzibilizátorů pro klasickou (barevnou i nebarevnou) a také IČ fotografii je zřejmé, že se jedná o cyaninová barviva. Jejich syntéza je nejlépe popsána ve Venkataramanovi. Příklady syntéz lze nalézt v následujícím obrázku 14-9.

Obrázek 14-9.
Příklady syntéz cyaninových barvivVe třetím syntetickém kroku lze použít jakoukoliv alkylamoniovou sůl jiného dusíkatého heterocyklu a připravit tak i nesymetrická cyaninová barviva.
Protože jsou obecně cyaninová barviva málo světlostálá, zlepšuje se jejich světlostálost "stabilizací" methinového můstku zavedením následujících struktur (obrázek 14-10).

Obrázek 14-10.
Substruktury zajišťující lepší světlostálost cyaninových barvivVýznamným polotovarem pro tyto účely je kyselina kvadrátová, případně krokonová (obrázek 14-11).

Obrázek 14-11. Cyaninová barviva na bázi kyseliny kvadrátové a krokonové
Krokoniová barviva jsou bathochromněji posunutá v porovnání s korespondujícími barvivy kyseliny kvadrátové, či ve srovnání s barvivem cyaninovým. Velmi úzký absorpční pás pak z nich činí IČ barvivo vhodné pro optické disky a užívají se také jako barviva laserová.
14.1.4 Barviva v instantních fotografických procesech
První instantní barevný film zavedla na trh firma Polaroid (Polacolor proces). Princip je ten, že film obsahuje světelně citlivé vrstvy (AgX emulze a senzibilizátory), a dále obsahuje vrstvu, kde jsou molekuly barvivo-vývojka, u kterých mezi barevným chromoforem (žluť, červeň, modř) a vývojkou (hydrochinon) je chemický můstek (izolant z hlediska konjugace). Jako můstek se používal např. alkylový řetězec (obrázek 14-12).

Obrázek 14-12.
Komponenty používané v instantní barevné fotografiiPo "nafotografování obrázku" nastává uvolnění alkálie, která vyvolá ionizaci hydrochinonových OH skupin (-OH ®
O-). Takto uvolněná molekula barvivo-vývojka následně difunduje k světelně citlivým vrstvám. Jestliže světelně citlivé vrstvy neobsahují žádné fotosenzibilizované stříbro, pak molekuly prodifundují až do tzv. přijímací vrstvy, kde se zachytí (protonizována kyselinou O-® OH). Jestliže světelně citlivé vrstvy obsahují fotosenzibilizované stříbro, jsou molekuly oxidovány tímto stříbrem na chinon (O-® =O) a sráží se. Obraz se tedy obdrží v přijímací vrstvě.V roce 1972 zavedla firma Polaroid další typ instantního filmu. Ten se liší od původního filmu v řadě věcí. Především se používají barviva kovokomplexní ( chromoforem je kovokomplexní barvivo), zatímco můstkem spojená vývojka zůstává stejná, např. červeň-vývojka (14.6).

V současnosti jsou tyto filmy v mnoha směrech vylepšeny, ale z hlediska barviv se stále používají barviva kovokomplexní, která jsou velmi světlostálá.
Kodak instant proces (firma Kodak) se liší od Polaroid procesu v tom směru, že se jedná o tzv. uvolňovací proces. Barvivo je opět navázáno na vývojku, ale tato molekula je oxidována na snadno hydrolyzovatelnou formu (obrázek 14-13), která
hydrolýzou "uvolní" barvivo (obrázek 14-14).
Obrázek 14-13. Oxidace komponenty barvivo-vývojka

Obrázek 14-14.
Uvolnění barviva hydrolýzou
Jako "BARVIVA" slouží barviva azová (obrázek 14-15).

Obrázek 14-15.
Azobarviva používaná v Kodak instantní barevné fotografii
14.2 Světlocitlivé azosystémy
Tyto systémy jsou založeny na faktu, že diazoniové soli se světlem rozkládají za vzniku příslušných fenolů (obrázek 14-16).
![]()
Obrázek 14-16.
Rozklad diazoniových sloučenin světlemPo barevné fotografii se asi před 10 lety jednalo o druhý nejdůležitější záznamový proces. Princip je ten, že papír (rovněž transparentní filmy pro mikrografii) je napuštěn diazoniovou komponentou a kopulační komponentou. Tento je ozářen UV zářením či modrým světlem. Tam, kde nedošlo k rozkladu diazoniové komponenty vznikne posléze vyvoláním parami čpavku barvivo (teploty nad 60
oC) a vznikne inverzní obrázek. UV světlo či modré se používalo proto, že v tomto rozsahu vlnových délek absorbovaly používané diazoniové sloučeniny.Originálně se používaly o-diazofenoly a jako kopulační komponenta např. 2-hydroxy-6-methoxy-3-naftoová kyselina (tzv. červená diazotypie). Později byly na trhu např. následující komponenty (obrázek 14-17).

Obrázek 14-17.
Aktivní a pasivní komponenty požívané v diazotypiiVe Filmfabrik Wolfen (bývalá NDR) vyvinuli barevnou diazotypii, protože bývalá NDR neměla k dispozici dostatek stříbra. Hlavním problémem bylo vyvinout tři diazoniové sloučeniny absorbující v potřebných částech viditelného spektra. Kopulační komponenta je samozřejmě bezbarvá. Následující tabulka 14-3 ukazuje složení jednotlivých vrstev filmu.
Tabulka 14-3.
Složení vrstev filmu pro barevnou diazotypii|
Vrstva |
Diazoniová komponenta l max |
Kopulační komponenta l max azo produktu |
|
žlutá |
|
|
|
purpurová |
|
|
|
azurová |
|
|
Hlavní nedostatek tohoto média spočívá v tom, že produkty rozkladu diazoniových sloučenin nejsou zcela bezbarvé a podání barev není tak úplně věrné.
Optický záznam informací založený na nekonvenčních fotografických procesech má v porovnání s halido-stříbrnou fotografií podstatně nižší fotocitlivost (tabulka 14-4).
Tabulka 14-4.
Citlivosti fotografických procesů
|
Citlivost (cm-1) |
Proces |
|
1 - 10-1 |
diazotypie |
|
10-2 |
fotochromismus |
|
10-3 - 10-4 |
fotoresist |
|
10-5 |
volné radikály |
|
10-6 - 10-9 |
AgX fotografie |
Naopak tyto nekonvenční procesy vynikají extrémně vysokou rozlišovací schopností, která je v podstatě dána pouze vlnovou délkou použitého (absorbovaného) záření.
14.3 Fotoresisty
Jedná se o systémy, kde vysoce světlocitlivý materiál se rozpuštěn v organickém rozpouštědle spolu s vysokomolekulárním polymerem. Po expozici světlem ozářené plochy se buď stanou nerozpustnými (
negativní fotoresist) a nebo naopak vysoce rozpustnými (positivní fotoresist). Tyto systémy se využívají v tisku integrovaných obvodů, v offsetovém tisku, reprografii, apod..Světlocitlivé systémy obsahují takové sloučeniny, které po excitaci zesíťují se svým okolím, vhodným
polymerem (obrázek 14-18).
Obrázek 14-18. Negativní fotoresist obsahující 2-azidopyren
Často polymer sám obsahuje azidoskupinu (14.7) a po absorpci záření opět dojde k zesíťování (negativní proces).
![]()
Může také obsahovat fotoreaktivní dvojnou vazbu (14.8) a po excitaci opět polymerovat.
![]()
Positivní fotoresist obsahuje o-chinondiazid, který naopak způsobí vysokou rozpustnost polymeru. Princip funkce je ten, že účinkem záření dojde k dediazotaci o-chinondiazidu a vzniku ketokarbenu, který Wolfovým přesmykem poskytne keten. Tento v přítomnosti vody reaguje za vzniku vysoce rozpustné inden-3-karboxylové kyseliny, která je tak odstraněna při vyvolávacím procesu (obrázek 14-19).

Obrázek 14-19. Mechanismus fotolýzy o-chinondiazidu
Co se týče přípravy azidosloučenin a jejich vlastností, pojednává o tom kapitola 12 (Reaktivní barviva)
14.4 Volné radikály
Jedná se o další nekonvenční fotozáznamovou techniku, kde fotolýzou haloalkánů (např. tetrabrommethanu) vzniknou radikály (např. tribrommethylový radikál), které jsou jako oxidační činidla schopny oxidovat bezbarvou sloučeninu (leukoformu) a vytvořit tak barvivo. Používají se leukoformy trifenylmethinových barviv, dále pak leukoformy cyaninů, xanthenů, apod. (obrázek 14-20).

Obrázek 14-20. Zobrazovací systém Horizons
Jako aktivátor se také často používá hexaarylbisimidazol (obrázek 14-21), který působením záření poskytne potřebný radikál.

Obrázek 14-21. Fotolýza hexaarylbisimidazolu
14. 5 Triplet - tripletová absorpce
Tento fotofyzikální proces je pro ochranu zraku, případně fotoelektronických zařízení, před silným zábleskem světla (jaderné výbuchy, apod.). Případně se využívá v tzv. ultrarychlé fotografii. Jedná se o "barviva", která jsou na přechodnou dobu vyvinuta UV zářením. Princip je ten, že polymerní vrstva "skel" brýlí obsahuje bezbarvou aromatickou látku (obrázek 14-22).

Obrázek 14-22.
Aromáty používané v triplet-tripletové absorpciTento ar
omát při záblesku absorbuje UV záření (které musí být dostatečně intenzivní), po excitaci přejde do stavu S1, odtud ISC přechodem do stavu T1. Tento ISC přechod musí být dostatečně efektivní (nejlépe, když se výtěžek tohoto procesu blíží k hodnotě 1). Protože stav T1 má velmi dlouhou dob dobu života (řádově sekundy), koncentrace molekul ve stavu T1 je tak velká, že viditelné záření obsažené v záblesku je absorbováno těmito molekulami ve stavu T1 (přechod ze stavu T1 do stavu T2) a funguje tak jako barvivo a ani UV, ani viditelné zážení neprojde a nepoškodí tak náš zrak. Po skončení pulzu, kdy přestane excitace UV světlem se system navrátí do základního stavu. Následující obrázek 14-23 ukazuje princip triplet-tripletové absorpce v Jablonského diagramu.
Obrázek 14-23. Triplet-tripletová absopce
Uvedený sytém funguje účinně pouze tehdy, když v polymerní matrici není přítomen kyslík, o kterém je známo, že je velmi účinným zhášečem tripletových stavů.
14.6 Barviva pro optické disky
Optický disk je dnes schopen mnohem hustšího záznamu informací, než např. magnetické disky. Magnetický disk v roce 1960 měl záznamovou hustotu 10
4 bit/cm2, komerční optický disk v roce 1990 měl 108 bit/cm2. V blízké budoucnosti to bude více než 1012 bit/cm2 (jenom pro srovnání, kapacita uložení genetických informací v DNA je 1021 bit/cm3 ).Spolupráce firem PHILIPS a SONY v 70-tých letech přinesla první audio-compact disky (CD), kde je informace zapsána laserem a laserem rovněž čtena (bez mechanického kontaktu). Používá se relativně levná laserová dioda a nebo Ga-As laser. Vlnová délka těchto laserů je v blízké IČ oblasti spektra a z toho vyplývá, že používaná barviva musí absorbovat v blízké IČ, to je 780-840 nm.
Existují tři druhy disků. První jsou již široce používané, kdy jednou uložená informace je v dalším používání pouze čtena (CD-ROM, Compact Disc - Read Only Memory). Další druhy disků, hlavně pak třetí skupina pro opakovatelný záznam a čtení informací (podobně jako magnetická páska) jsou stále ve vývoji, a je otázkou, zda-li kvůli kopírovacím právům budou firmy ve vývoji těchto médií pospíchat. Navíc možná budou tato média předstižena paměťovými chipy.
Většina systémů pro zápis informace na CD-ROM pracuje teplotní technikou. Laserový paprsek vytvoří na záznamové vrstvě obarvené IČ barvivem rýhy o průměru 1 m m. Energie absorbovaná barvivem taví vrstvu vytvořenou polykarbonátem a nebo polymethylmetakrylátem za vzniku rýhy.
Barvivo musí být fotochemicky a termicky stabilní, rovněž se nesmí časem, ani fotochemicky oxidovat.
Prvním barvivem tohoto druhu bylo naftochinonové barvivo následující struktury (14.9).

Později se začalo používat dihydroxykvadrátové barvivo, připravené kondenzací z kvadrátové kyseliny a alkylovaného anilinu (obrázek 14-24).

Obrázek 14-24. Syntéza barviva na bázi kvadrátové kyseliny a aromatického
aminu
V roce 1985-86 byl uveden na trh optický systém DRAW (Direct Reading After Writi
ng) pracující podobně jako systém WORM (Write Once Read Many), kde jako barvivo absorbující v IČ se používá dithioláto nikelnatá sůl heptamethin cyaninu (14.10).
V případě optických disků s možností opakování zápisu - systém EDRAW (Erasable Direct Read After Write) nemůžou vznikat žádné neodstranitelné rýhy, ale systém musí pracovat jinak. Například 1,4-diketo-3,6-[
2´,2´´-methoxy-fenyl] pyrolo-[ 3,4-c] pyrol (14.11) krystaluje ve dvou modifikacích.
Slabě fluoreskující oranžová modifikace B se pomocí nízké termické energie (E
a = -6,3 kJ/mol) přemění na silně fluoreskující modifikaci A.Vývoj v této oblasti je velmi rychlý, např. firma SONY přišla na trh s optickým diskem o průměru 8 cm a kapacitou záznamu okolo 100000 stránek textu.
Do této kapitoly patří všechna infračervená barviva, to je barviva, která, jak už bylo řečeno, absorbují v blízké infračervené oblasti spektra. Pro nás jsou z hlediska tradic našeho barvářského průmyslu zajímavé následující strukturní třídy IČ barviv. Za prvé jsou to IČ azobarviva, o kterých pojednává kapitola 10.13. Za druhé jsou to naftocyaninová barviva, o kterých najde čtenář informaci v kapitole 8.2.
Třetí skupinou (dosud neprobranou) jsou kovokomplexní infračervená barviva. Ve shodě s poznatky z barviv klasických (textilních), kovokomplexní IČ barviva vynikají vysokými světelnými stálostmi. Kromě toho, že se používají v optických discích, nalezla použití ve slunečních brýlích, jako laserová barviva, jako antioxidanty a zhášeče singletového kyslíku při ochraně barviv před fotoblednutím.
Prvním typem jsou dithiolenové kovové komplexy (14.12).

Je-li R1 a R2 = CF3
, potom Ni barvivo absorbuje při 715 nm a má log e = 4.09 (měřeno v heptanu). Jedná-li se o fenyly, potom Pd barvivo absorbuje při 885 nm (log e = 4,61). Následující obrázek 14-25 ukazuje jednu ze syntéz bisdithiobenzilového komplexu.
Obrázek 14-25. Syntéza bisdithiobenzilového komplexu
Samozřejmě existují i
benzen-1,2-dithiolátové kovové komplexy (14.13), jejichž prekurzory jsou dithioláty (ligandy).
Druhou skupinou jsou fenylendiaminové kovové komplexy
(14.14), které jsou v porovnání s dithiolenovými komplexy bathochromně posunuty a jsou také světlostálejší.

Třetí skupinou jsou
indoanilinové kovové komplexy, které se připravují následujícín způsobem (obrázek 14-26).
Obrázek 14-26.
Příprava indoanilinového kovového komplexuV případě, že R = Et, R
2 = Me a M = Cu, potom maximum absorpce je 776 nm (měřeno v ethanolu) a absorpční molární koeficient je velmi vysoký (log e = 5,15).14.7 Dichroická barviva pro kapalné krystaly (displaye)
Moderní hodinky, kalkulátory, apod. mají tzv. displaye z kapalných krystalů (LCD - Liquid Crystal Display). Některé organické sloučeniny, které mají tvar dlouhých dipolárních tyčinkovitých molekul (přitom dosti rigidních) tvoří jednu nebo více kapalných
krystalických fází mezi pevnou krystalickou fází a kapalnou amorfní fází (isotropní). První kapalnou krystalovou fázi popsal jako kuriozitu u benzoátu cholesterolu v roce 1888 chemik F. Reinitzer. Toto platilo až do roku 1960, kdy se tento obor začal velmi rychle rozvíjet.Existují tzv. čtyři
meso fáze. Ve fázi smetické molekuly leží paralelně jedna vedle druhé, přičemž jejich konce leží v jedné linii tvoříce tak tenkou vrstvu. Nyní je známo více než deset polymorfních smetických fází.Pro LCD aplikace ale mají význam pouze následující dvě fáze.
Nematická fáze, kde se netvoří vrstva, ale pouze statistická paralelní orientace. Druhá je tzv. cholesterolová fáze, která je tvořena opticky aktivními molekulami, kde tato fáze připomíná zásobník štítků.Čtvrtý typ, tzv.
discotická fáze byla objevena v roce 1981 u planárních hexagonálních sloučenin, ale doposud nenašla uplatnění u LCD aplikací.Pro LCD aplikace musí být sloučeniny v nematické fázi v teplotním rozsahu -40 až 80
oC. Měly by být dostatečně termicky a fotostálé s dobrou kapacitou pro rozpuštění dichroických barviv. V současnosti se LCD vytváří z eutektických směsí více než deseti látek. Používají se směsi obsahující 4-kyano-bifenyl nebo 4-kyano-trifenylové sloučeniny (14.15).
Nebo se používají 1-kyano-fenyl či 1-kyano-bifenylové sloučeniny s cyklohexanovou skupinou ve 4´- pozici (14.16).

Chirální přísada (14.17) dokáže pak přeměnit celou směs z nematické fáze na cholesterolovou.

Klasický kapalný krystal leží mezi dvěma světlopolarizujícími destičkami, které jsou na vnitřní straně pokryty transparentní vrstvou SnO
2 a nebo In2O3. Tyto oxidy slouží jako elektrody, které vytváří elektrické pole. Působením elektrického pole dojde k orientaci dipolárních kapalných krystalů a tím ke změně jasu. Tyto displaye byly ale málo výrazné. Proto pro zvýšení kontrastu se dnes v cholesterolovém kapalném krystalu rozpuští dichroické barvivo. Tato barviva musí být velmi čistá, velmi fotostálá a samozřejmě dichroická. Působením elektrického pole dojde nejen k orientaci molekul kapalného krystalu, ale i molekul barviva (jednotné uspořádání v prostoru). Dichroismus je jev, kdy barvivo má velmi rozdílné adsorpční koeficienty vůči světlu, které je polarizováno paralelně (AII) nebo perpendikulárně (A^ ) vůči směru paralelně a homogenně uspořádaným molekulám barviva v LCD filmu. Vyjádříme-li parametr S z naměřených absorbancí:S = (AII - A^ )/(AII + 2A^ )
potom většina dichroických barviv má S kladné. V současnosti se používají barviva soustředěná v obráz
ku 14-27.
Obrázek 14-27. Dichroická barviva
14.8 Laserová barviva
Od roku 1966 jsou fluoreskující barviva a opticky zjasňující prostředky důležitá pro tzv. "barvivové lasery".
Laser je zařízení pro zesílení nebo přípravu koherentního světla v ultrafialové, viditelné a nebo infračervené oblasti spektra. Pojem laser je zkratka "light amplification by stimulated emission of radiation". Princip laseru byl předpovězen v roce 1917 A. Einsteinem. První laser začal pracovat v roce 1960. V současnosti se jedná o nejdůležitější zdroj koherentního a přísně paralelního světla a je používán pro zisk monochromatického zážení velmi vysoké hustoty energie nebo extrémně krátkých pulsů (piko až fentosekundové pulsy).
14.8.1 Kvantová mechanika (fyzikální podpora probírané problematiky)
Jmenujme základní postuláty, na jejichž základě můžeme vybudovat logickou stavbu kvantové mechaniky. Vyslovíme je pro jednu částici bez spinu.
1/ Fyzikální stav částice v okamžiku t je popsán komplexní vlnovou funkcí Y
(x,t).2/ Vlnová funkce Y
(x,t) a její první a druhá derivace musí být spojité, konečné a jednoznačné pro všechny hodnoty x.3/ Každá veličina, jež je fyzikálně pozorovatelná, může být reprezentována hermitovským operátorem. Hermitovský operátor je lineární operátor H , který pro libovolnou dvojici funkcí popisujících fyzikální stav částice splňuje podmínku:
![]() .
.
4/ Přípustným výsledkem měření nějaké veličiny F reprezentované operátorem
F je kterákoliv z vlastních hodnot fi veličiny F, pro něž platí:FY i = fi Y i .
Poznámka : operátor není nic jiného než nějaký matematický předpis (např. derivace je operátor), kterým se působí na nějakou funkci a ve výše uvedeném případě působením operátoru je výsledkem daná funkce vynásobená nějakou konstantou.
5/ Střední, čili očekávaná hodnota á
Fñ libovolné měřitelné veličiny F, jež odpovídá operátoru F, se vypočte podle vzorce:á Fñ =  .
.
Tato formulace předpokládá, že vlnová funkce je normovaná, tzn., že platí:
![]() .
.
Poznámka: Y *
je funkce komplexně sdružená.6/ Kvantově mechanický operátor odpovídající dané fyzikální veličině se získá tak, že se napíše klasický výraz pro tuto veličinu jako funkci proměnných x, p
x, t a E a tento výraz převedeme na operátor s použitím těchto pravidel (tabulka 14-5).Tabulka 14-5.
Konverzní tabulka pro přechod od klasických veličink veličinám kvantově-mechanickým
|
Klasická proměnná |
Operátor |
Výraz pro operátor |
|
x |
x |
x |
|
px |
px |
|
|
t |
t |
t |
|
E |
E |
|
7/ Vlnová funkce Y
(x,t) je řešením časově závislé Srödingerovy rovnice:H(x,t) Y (x,t) = ![]() ,
,
kde H
(x,t), nebo-li zkráceně H je Hamiltonův operátor. V případě částice, jež je vystavena působení konzervativních polí, je klasická hamiltonova funkce dána prostě součtem potenciální a kinetické energie:H = U(x,t) + ![]() .
.
Z postulátu č.6 tudíž vyplývá výraz pro operátor:
H = U(x,t) - ![]() .
.
Dosadíme-li operátor H do Schrödingerovy rovnice, pak získáme parciální diferenciální rovnici:
U(X,t)* Y - ![]()
Z tabulky u postulátu č. 6 víme, že výraz na pravé straně výše uvedené rovnice je operátor energie, nebo-li dostáváme známý vztah, že:
HY = EY .
Není-li potenciální energie funkcí času, potom lze provést separaci proměnných:
Y (x,t) = y (x)* y (t) .
Vlnová funkce v kvantové mechanice odpovídá vlnění struny:
Y = A*exp[ -iw (t
-![]() )] .
)] .
Jelikož platí, že E = hn
, tak lze napsat:Y = A*exp[ - (![]() ) (Et -px)] ,
) (Et -px)] ,
Y (x,t) = y (x)*exp[ -
![]() ] .
] .
Jelikož se potenciální energie nemění s časem, je celková energie konstantní a operátor
E = E, nebo-li :Hy (x) = Ey (x) .
14.8.2 Absorpce či emise světla
Atom či molekulu lze popsat vlnovou rovnicí:
HoY = ![]() ,
,
kde Ho
je hamiltonián neporušeného systému (molekula před absorpcí fotonu). Řešení této rovnice vede k sadě dovolených vlnových funkcí odpovídajících dovoleným hodnotám energií En stacionárních stavů, přičemž platí:![]() ,
,
kde q označuje souřadnice a Y
no je časově závislá vlnová funkce elektronu ve stavu s kvantovým číslem n a energií En. Komplexně sdružená funkce je:![]() .
.
Střední poloha elektronu je střední hodnotou x:
á xñ = ![]() .
.
Dosazením vlnové funkce dostaneme vztah:
á xñ = ![]() .
.
Vidíme, že se časový člen zrušil, což znamená, že elektron nekmitá a molekula (či atom) nevyzařuje žádnou energii.
Nyní můžeme vyšetřovat elektron, který přechází z jednoho energetického stavu do druhého. Molekula (atom) je ve svém základním stavu, když v okamžiku t=0 začne působit nějaký excitační proces. Elektron přejde ze základního stavu E
n do excitovaného stavu Em a následně zjistíme, že molekula vyzařuje energii a přechází zpět do stavu základního. V nějakém čase musela být molekula ve stavu Em. Vlnovou funkci Y molekuly schopné existence ve stavu En nebo Em lze napsat jako superpozici obou stavů:Y = aY n + bY m ,
kde výraz aa*
je pravděpodobnost výskytu elektronu ve stavu n, bb* je pravděpodobnost výskytu ve stavu m a samozřejmě platí:aa* + bb* = 1 .
V čase t=0 je a=1, b=0; v excitovaném stavu je b=1, a=0. Při přechodu ze stavu m do n jsou a i b nenulové a střední polohu elektronu, kdy vznikají elektromagnetické vlny lze popsat jako:
á xñ = ![]() .
.
Roznásobením a separací vlnové funkce na součin:
![]() ,
,
dostaneme následující výraz pro stře
dní polohu elektronu á xñ =:
kde, jelikož platí, že exp(ia
) + exp(-ia ) = 2*cos(a ), lze třetí člen zjednodušit na výraz:![]() .
.
Vidíme, že časově závislý faktor je :
![]() ,
,
přičemž to, že frekvence je úměrná energetickému rozdílu hladin:
![]() ,
,
je známou Bohrovou podmínkou absorce či emise fotonu molekulou (atomem). Vidíme, že poloha elektronu osciluje jako kosinus s frekvencí n
a vznikají tak elektromagnetické vlny se stejnou frekvencí.K určení n jsme nepotřebovali znát hodnoty a,b ani vlnové funkce y
n, y m. Musíme je ale znát, chceme-li počítat výkon emitovaného záření. Z principu neurčitosti nelze a,b určit přesně, ale tak jako tak platí, že![]() .
.
Uvažujme dvě energetické hladiny molekuly m,n kde n je hladina nižší a m vyšší. Pravděpodobnost, že molekula vykoná takovýto přechod je úměrná intenzitě (výkonu) dopadajících fotonů. Pravděpodobnost přechodu také závisí na vlastnostech stavů m a n a tuto vlastnost zahrneme do nějaké konstanty B
n,m. Takže, osvětlíme-li molekulu v základním stavu n světlem o frekvenci n , pak pravděpodobnost přechodu je úměrná součinu Pn® m = Bn,m*u(n ) , kde u(n ) je hustota energie.Je-li molekula v horním stavu m, existuje určitá pravděpodobnost samovolného přechodu do stavu n vyjádřená jako A
m,n. Předpokládejme rovněž, že dopadající světlo nějak indukuje přechod do nižšího stavu n. Celková pravděpodobnost přechodu dolů pak bude Pm® n = Am,n + Bm,n* u(n ). Koeficienty A,B se nazývají Einsteinovy koeficienty.Budeme vyšetřovat soubor N
n molekul ve stavu n a Nm molekul v excitovaném stavu m. Platí, že:Nn Pn® m = Nn Bn,m*u(n ) ,
Nm Pm® n = Nm (Am,n + Bm,n* u(n )) .
Oba procesy svítíme-li pořád musí být v rovnováze, takže:
Nn Bn,m*u(n ) = Nm (Am,n + Bm,n* u(n )) .
Pro hustotu energie pak platí, že:
 .
.
Z Maxwell-Boltzmanova rozdělovacího zákona platí, že poměr obsazení dvou energetických hladin je roven:
![]() .
.
Dosazením tohoto poměru do vztahu pro výpočet hustoty energie dostáváme, že:
 .
.
Je vidět, že má-li být tento vzorec v souladu s Planckovým vyzařovacím zákonem:
 ,
,
potom se Bn,m musí rovnat Bm,n
. Dále je vidět, že poměr mezi koeficienty spontánní a indukované emise závisí na třetí mocnině frekvence záření:![]() ,
,
a pravděpodobnost samovolné emise rychle roste s energetickým rozdílem mezi oběma uvažovanými stavy n a m.
Jelikož hn je normálně mnohem větší než kT, tak je jasné, že v tepelné rovnováze obsazení excitovaného stavu je značně menší než obsazení základního stavu, či-li N
n > > Nm. Z toho vyplývá, že záření hn bude převážně absorbováno molekulami v základním stavu n, protože koncentrace vyšších stavů je velmi nízká oproti koncentraci molekul v základním stavu (obrázek 14-28).
Obrázek 14-28. Absorpce systému, kde jsou molekuly v základním stavu
Zajistíme-li ale (jakýmkoliv způsobem), aby koncentrace molekul v excitovaném stavu byla srovnatelná a nebo větší než koncentrace molekul ve stavu základním, potom vzledem k rovnosti koeficientů B
n,m = Bm,n je indukovaná emise stejně pravděpodobná jako absorpce (obrázek 14-29). (Je to totéž, jako kdybychom udeřili do rozhoupaného kyvadla. Buď kyvadlo urychlíme a nebo zpomalíme a oba jevy jsou stejně pravděpodobné).
Obrázek 14-29. Vznik stimulované emise
Takže shrnuto, podmínky pro stimulovanou emisi jsou, aby populace excitovaného stavu S
1 byla v okamžiku záblesku vyšší než stavu So. Populaci S1 stavu zvyšujeme např. "optickým pumpováním", to jest kontinuálním ozařováním soustavy a excitací molekul do stavu S2 ( hn 2 = E2 - Eo). Takto dodaná energie se zčásti ztratí přechodem do stavu So, zčásti pak přechodem do stavu S1, což postačí k vyvolání stimulované emise, protože přechodem S1® So se uvolní foton (hn 1 = E1 - Eo), který vyvolá indukovanou emisi (obrázek 14-30).
Obrázek 14-30. Princip barvivového laseru
Nejdůležitější vlastnost barvivového laseru je jejich schopnost kontinuálního ladění. Barvivový laser je obvykle pumpován jiným laserem, např. plynovým. V současnosti se nejvíce používá k pumpování tzv. excimerový laser (XeCl laser), který produkuje monochromatické záření vlnové délky 308 nm, což je vlnová délka absorpce většiny barviv. Z toho vyplývá, že barvivový laser pak může pracovat v rozsahu od cca. 320 do 1200 nm. Následující tabulka 14-6 udává přehled pouřívaných laserových barviv, lépe řečeno typů barviv.
Tabulka 14-6.
Přehled typů laserových barviv|
Rozsah emise(nm) |
Strukturní typ |
|
340 - 430 |
stilbeny |
|
360 - 480 |
oxazoly |
|
410 - 440 |
antraceny |
|
440 - 520 |
akridiny |
|
460 - 540 |
kumariny |
|
510 - 700 |
xanteny |
|
540 - 1200 |
cyaniny |
|
630 - 720 |
oxaziny |
Lasery, které používají pro pumpování "normální zábleskové lampy" (např. Xe výbojky) převedou na laserovou energii pouze 2% energie. To je způsobeno tím, že barvivo má uzký absorpční pás v porovnání se širokým emisním pásem zdroje (pumpy).
Účinnost přeměny energie může být zvýšena, spojíme-li kovalentní vazbou donorové barvivo s akceptorovým barvivem. To je např. kombinace 1,4-di-[
2-(4-methyl-5-fenoxazoyl)-benzenu] se stilbenem (14.18).
V tomto bifluoroforním systému přenos energie trvá méně než 1 ps.
Kritéria pro vhodnost barviva jakožto laserového barviva jsou následující:
- vysoký kvantový výtěžek fluorescence (F
F > 0,7);- krátká doba života S
1 stavu (t F < 10 ns);- malý mezisystémový přechod na tripletový stav;
- velkou absorpci v oblasti pumpování;
- vysokou fotochemickou stabilitu.
V posledních letech se výrobci zaměřili na zlepšení fotostability laserových barviv. Jako příklad se uvádí náhrada methylskupiny, která byla zdrojem fotodegradace, skupinou trifluoromethylovou, např. v Kumarinu 152 (fy. Kodak) (14.19).

Jinou možností je přidávání vhodných aditiv, např. 1,4-diazabicyklo[
2,2,2] oktanu (14.20), který v soustavě slouží jako účinný zhášeč singletového kyslíku.
Laserová barviva nemusí být jenom v roztoku, ale mohou jako aktivní médium být i v parách. Nejznámějšími a asi nejúčinnějšími barvivy tohoto druhu jsou tzv. POPOP barviva (anglicky phenyl-oxazole-phenylene-oxazole-phenyl) (14.21).

14.9 Fotochromní barviva
Fotochromismus je jev, kdy absorpční spektrum molekuly (nebo krystalu) se reversibilně mění, je-li vzorek ozařován zářením určité vlnové délky. Například, bezbarvá látka A se po ozáření UV žářením stane barevnou sloučeninou B, která může být absorpcí viditelného záření a nebo teplem převedena zpět na látku A.
Sloučeniny vykazující fotochromismus nalezly použití jako dozimetrické materiály, záznamové filmy, případně v dekorativních nátěrech.
Následující tabulka 14-7 udavá přehled typických fotochromních sloučenin.
Tabulka 14-7.
Přehled fotochromních barviv|
Typ sloučeniny |
Fotochromní reakce |
|
azobenzen |
|
|
salycilidenanilin |
|
|
xanthen |
|
|
oxazin |
|
|
thioindigo |
|
|
fulgid |
|
|
dihydropyren |
|
|
spiropyran |
|
|
aziridin |
|
V současnosti se s fotochromními barvivy počítá v optických záznamových médiích a "molekulárních elektronických zařízeních". Správný fotochromní systém musí být schopen mnohonásobného reversibilního cyklu aniž by nastalo fotovyblednutí barviv. Protože probíhá na molekulární úrovni, vykazuje velmi vysokou rozlišovací schopnost. Např. se využívá v mikrofilmech, kde 35 mm obrázek může zaznamenat 1200 knižních stránek.
Pro optické disky je ale potřeba, aby byly vyvinuty sloučeniny, které budou absorbovat v infračervené oblasti spektra (oblast emise používaných laserových diod). Takové jsou například sloučeniny obsahující benzothiopyran (obrázek 14-31).

Obrázek 14-31. Fotochromní barvivo benzothiopyranového typu
Výše uvedený merocyanin je stabilní ale pouze za velmi nízkých teplot. Proto byly připraveny deriváty, obsahující nitroskupinu v poloze 6, které jsou stabilní za normální teploty a absorbují v oblasti 700-850 nm. Jejich syntéza je naznačena v následujícím
obrázku 14-32.
Obrázek 14-32.
Příprava fotochromního derivátu merocyaninuVelmi podobně se chovají spiroindolinonaftoxaziny, které se snadno připraví z 1-nitroso-2-naftolu a 3,3-dimethyl-2-methylenindolinu (obrázek 14-33).

Obrázek 14-33. Syntéza derivátu spiroindolinonaftoxazinu
14.10 Barviva pro konverzi sluneční energie
Využití sluneční energie je jedním z hlavních úkolů lidstva. V následujících kapitolách popíšeme několik způsobů (ve kterých nějakou roli hrají organická barviva), jak tuto energii uchovávat, či přeměňovat na jiný druh energie (energii elektrickou).
Přímá fotochemická konverze sluneční energie, kde se z vody získává vodík a kyslík (fotolýza vody), je v současnosti předmětem širokého výzkumu. Nelze podat vyčerpávající přehled publikovaných prací a proto se soustředíme spíše na vysvětlení daného probl
ému.Sluneční záření, které dopadá na povrch naší země, má přibližně 2% celkové energie v UV oblasti spektra, 40% ve viditelné oblasti spektra a zbytek je infračervené záření (viz kapitola pojednávající o trichromatických souřadnicích).
Při ukládání energie slunečního žáření musíme mít na paměti jednu skutečnost, která je dobře viditelná v Jabloského diagramu (obrázek 14-34).

Obrázek 14-34. Jablonského diagram
Jelikož přechody ze stavu S
2 do S1, případně z S1 do T1 jsou nezářivé a velmi rychlé, tak využitelná energie je dána rozdílem stavů barviva E1 - E0, případně ET1 -E0. Energie E2 - E1 (případně E2 - ET2) je ztracená tepelnou disipací.Dnes již klasickým příkladem fotolýzy vody je systém, který využívá dikationt dimethylviologenu jako akceptoru elektronu a trisbipyridylruthenium-(II)-dikationtu jako donoru elektronu (obrázek 14-35).


Obrázek 14-35. Donor-akceptorní systém pro fotolýzu vody
Dimethylviologen dikationt má maximum absorpce 396 nm (42000 l.mol-1.cm-1) a 602 nm (11000 l.mol-1.cm-1), trisbipyridylruthenium-(II)-dikationt má maximum absorpce 452 nm (14500 l.mol-1.cm-1). Fotoexcitovaný Ru(BPY)3+2 redukuje MV+2 na radikal kationt MV+.
. Zpětná oxidace MV+. probíhá na platinovém gelu za současného vzniku vodíku, zatímco zpětná redukce Ru(BPY)3+3 probíhá za katalýzy RuO2 (velmi jemná disperze, reakce probíhá na povrchu částic) za současného vzniku kyslíku (obrázek 14-36).
Obrázek 14-36. Celkové schéma fotolýzy vody
Ideální stav by byl ten, kdyby systém byl doplněn membránami (intenzivně se zkoumá), které by zajistily okamžitou separaci vzniklého kyslíku od vodíku. Tak jako tak, výše uvedený systém není příliš efektivní.
Podstatně lepších výsledků co do účinnosti konverze sluneční energie bylo dosaženo v tzv. fotovoltaických článcích. Vědci z firmy Shell a Cambridské University zjistili, že organická barviva lze použít k posílení
solárních cel. Cela se skládá z barviva vloženého mezi tenkými vrstvami Al/Al2O3 a zlata. Světlo projde transparentními vrstvami kovu, je absorbováno barvivem, které přejde do excitovaného stavu a emituje elektrony. Elektony přejdou k neobsazeným místům Al povrchu procesem, který je podporován elektronegativními dopanty typu kyslík, voda, jód (mechanismus celého procesu není příliš objasněn). Napříč střední vrstvou se tak utvoří elektrické napětí. Účinnost 0,31% těchto solárních cel byla malá ve srovnání s používanými celami křemíkovými (až 20%) - kosmické stanice. Jako barviva se používaly ftalocyaniny nebo merocyaniny, například (14.22).
Výzkum v oblasti fotočlánků ale rychle postupuje. Např. v roce 1990 byl patentován fotovoltaický článek, ve kterém se rubidiový komplex s 2,2´-dipyridylovými ligandy používá k
fotosenzibilizaci TiO2 (polovodič). Tento systém má podstatně vyšší účinnost konverze sluneční energie na energii elektrickou, než je tomu u přímé fotolýzy vody. Přítomnost optického senzibilizátoru (barviva) je nezbytná, protože kvalitní anorganické polovodiče typu TiO2 nebo SrTiO3 mají maximum absorpce v UV oblasti spektra. Velmi zajímavé je, že systém je dostatečně efektivní, pokud TiO2 film má zvláštní fraktálovou strukturu. Jako další "barviva" pro fotovoltaické články byly testovány následující sloučeniny, např. kumarin 343 (14.23),
který má ovšem maximum absorpce v UV oblasti spektra, a nebo různé deriváty trinukleárního Ru komplexu (14.24).

Tyto Ru komplexy vykazují maximum účinnosti mezi 400 - 550 nm v závislosti na jejich absorpčním maximu. Nejvyšší dosažená účinnost přeměny solární energie byla 11,3% (vztaženo na energii světla dopadajícího). Pro porovnání, účinnost fotosyntézy v přírodě je cca. 20% (viz kapitola pojednávající o úloze barviv při fotosyntéze). Odtud vidíme, že na zemi je nejlepší sázet stromy.
Jelikož hustota energie slunečního záření je nízká (cca. 800-1200 W/m
2), je často zapotřebí světlo koncentrovat. K tomu slouží v případě světla směrového čočky a zrcadla. Difuzní záření (je pod mrakem) lze koncentrovat fluorescenčními kolektory. Fluorescenční kolektor je deska z polymerního materiálu o vysokém indexu lomu (např. plexisklo, nD20 @ 1,5), která je vybarvena fluorescenčním barvivem. Světlo vstoupí do vnitřního prostoru, je absorbováno barvivem, vyzářeno fluorescencí do všech směrů, ale většina záření neopustí díky vysokému rozdílu indexů lomu vnitřní prostor desky a koncentruje se na jejích hranách, odkud je vyzářeno. Vhodnou geometrií desky lze dosáhnout násobícího faktoru zvýšení hustoty energie většího než 200. Tyto kolektory nejsouzatím příliš rozšířeny, protože fluorescenční barvivo musí být extrémně světlostálé. Kvantový výtěžek fotodegradace barviva musí být z technického hlediska menší než 1.10-8 a navíc produkty fotodestrukce barviva nesmí zhášet fluorescenci.Velmi nadějnými fluorescenčními barvivy (pigmenty) jsou sloučeniny naložené na
diketo-pyrolo-pyrolovém skeletu (DPP pigmenty) (kapitola 9.8).Další možností zpracování sluneční energie je její přeměna na energii chemickou (molekulární ukládání energie). Velmi známá je valenční isomerizace norbornadienu (obrázek 14-37).

Obrázek 14-37.
Ukládání energie UV záření pomocí valenčníisomerace norbornadienu
Má to ovšem tu nevýhodu, že norbornadien absorbuje pouze UV záření 200-300 nm. Někdy se k tomuto systému přidávají fotosenzibilizátory benzofenonového typu, tak, aby se využilo i dlouhovlnnější UV záření.
Zavedením elektron-donorních a akceptorních skupin do molekuly norbornadienu se docílí bathochromního posunu jejich absorpce do viditelné oblasti spektra. Například následující derivát (obrázek 14-38) má široký absorpční pás s maximem 420 nm (log e
@ 3), který zasahuje až do přibližně 550 nm.
Obrázek 14-37.
Ukládání sluneční energie pomocí valenční isomeracevhodného derivátu norbornadienu
Kvantový výtěžek se blíží jedné, a to i v přítomnosti molekulárního kyslíku.
Jako katalyzátory pro zpětnou tepelnou reakci se používají deriváty cyklopropenyliden paladium (II) komplexu (14.25).
