 |
| Jaroslav Heyrovský |
Polarografie je elektrochemická metoda, sloužící k určování výskytu a koncentrace látek v roztoku - tedy k chemické analýze. Objevil ji akademik Jaroslav Heyrovský v roce 1922 a získal za ni Nobelovu cenu v roce 1959. Princip spočívá ve vyhodnocování závislosti el. proudu na napětí přivedeném na dvojici elektrod, ponořených do elektrolyzovaného roztoku. Na křivkách se objevují tzv. polarografické vlny a jejich poloha charakterizuje jednotlivé druhy látek. Koncentrace příslušné látky se posléze určí z velikosti nárůstu proudu.

Pozn.: Aby platila derivace tak, jak je znázorněna, musí být vzestup na křivce konvexně-konkávní a pík je vmístě inflexního bodu..

Jako dokonale polarizovatelná elektroda (katoda)
slouží většinou rtuťová kapková elektroda, jako
referenční lze použít např. argentochloridovou elektrodu. Na
povrchu kapky rtuti se vytvoří elektrická dvojvrstva. Při
zvyšování potenciálu mezi anodou a katodou dochází k
vylučování příslušných iontů na katodě a tím k
nárůstu proudu. Proud je limitován množstvím iontů, které
mohou ke katodě z roztoku přicházet. Jakmile se množství
vylučujících se iontů rovná počtu přicházejících iontů
z roztoku, proud se přestane zvětšovat. Hodnota tzv.
půlvlnného potenciálu (střed nárůstu polarizační křivky)
je charakteristická pro danou látku (a použité elektrody). Do
roztoku se navíc přidává silný základní elektrolyt -
kyselina apod., aby se vodivost roztoku zvýšila. Pro každé
měření se vytváří nová rtuťová kapka.
Na obrázku je uveden příklad polarograf. křivky pro dvě
zkoumané látky, jejichž půlvlnné potenciály leží blízko
sebe. Pro přesnější vyhodnocování se proto často
používá derivovaná křivka, z níž lze samozřejmě
určovat totéž co z křivky první.
Z naměřené křivky stanovíme dle poloh jednotl. peaků,
jaké látky roztok obsahuje. Koncentraci dané látky pak lze
určit např. metodou standartního přídavku. Měření se
provádí vícekrát, přičemž se do roztoku přidává známé
konstantní množství látky. Srovnáním křivek původního
roztoku a roztoku po přidání urč. množství látky se
určí, jaký nárůst proudu odpovídá tomuto množství a
poté se z výšky původního "peaku" vypočte
odpovídající koncentrace.
 |
Typické polarografická křivka (závislost proudu I na napětí E): nižší křivka - doprovodný roztok chloridu amonného a hydroxidu obsahuje malá množství kadmia, zinku a manganu, horní křivka - stejná po přidání malého množství thallia. |
Výhod tohoto geniálního uspořádání je hned několik: sodík i většina dalších kovů se ve rtuti snadno rozpouštějí a tím je jim zabráněno reagovat s vodou za vývoje vodíku. Povrch elektrody zůstává čistý a navíc je odkapáváním rtuti neustále obnovován. Tím se současně lehce míchá roztok v okolí elektrody, takže koncentrace iontů zde neklesá a udržuje se na stále stejné hodnotě. Proud procházející elektrodou sice poněkud kolísá podle velikosti kapky, ale jeho průměrná hodnota zůstává stálá a zcela reprodukovatelná.
Princip lze dokonce použít ke stanovení současně několika různých iontů současně. Využívá se přitom toho, že různé kovy se vylučují z roztoku různě obtížně. Ušlechtilé kovy jako měď nebo stříbro se na rtuti vylučují snadno již velmi nízkým napětím. Méně ušlechtilé, jako zinek, hliník nebo olovo vyžadují napětí vyšší. Elektrický proud potřebný k vylučování jednotlivých prvků z roztoku se při postupném zvyšování napětí postupně sčítá a vytváří v závislosti na polarizačním napětí typickou schodovitou křivku, tzv. polarogram, podle kterého získala nová voltamperometrická metoda název polarografie. Na svislou osu je přitom vynášen proud, na vodorovnou polarizační napětí na elektrodách. Z výšky "schodů" na polarizační křivce lze přitom velmi přesně určit koncentraci jednotlivých iontů v roztoku, z jejich polohy na vodorovné ose pak zase druh
iontu 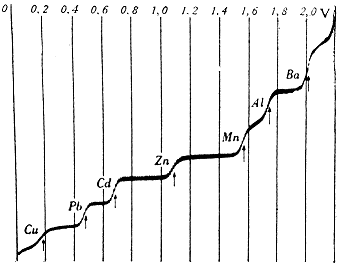

Spolupracovníci Jaroslava Heyrovského
Odjinud
Z již nefunkční adresy: http://fzp.ujep.cz/~synek/analytika/texty/5Polarografie.doc (okopírováno přes archiv)
Polarografie
je založena na elektrolýze roztoku stanovované látky.
Proud prochází roztokem mezi dvěma elektrodami, z nichž
jedna je tzv. dokonale polarizovatelná (viz níže,
realizována jako rtuťová kapková elektroda) a druhá
je tzv. nepolarizovatelná elektroda (viz níže).
Stanovovaná látka musí být schopná redukce nebo případně
oxidace na polarizovatelné elektrodě. Při klasickém
uspořádání zvyšujeme zvolna napětí vkládané na obě
elektrody a sledujeme, jak se mění proud protékající
obvodem v závislosti na vkládaném napětí (vkládané
napětí odpovídá rozdílu potenciálů obou elektrod, takže
často bývá sledována závislost proudu na potenciálu jedné,
a to polarizovatelné elektrody, I v závislosti na E). Při
malých hodnotách vkládaného napětí roztokem neprochází
elektrický proud, protože vložené napětí nepřekročí
tzv. rozkladné
napětí
stanovované látky (na elektrodách nemohou probíhat
elektrochemická reakce, které zajišťují přechod nábojů
mezi kovem a roztokem). Když vnější napětí přesáhne
napětí rozkladné, roztokem začne proud protékat a
zvyšuje se s rostoucím vkládaným napětí. Velikost
proudu je omezena rychlostí, jíž jsou částice stanovované
látky přiváděny difúzí k povrchu elektrody, kde
elektrochemicky reagují (přijímají nebo odevzdávají
elektrony), a tak zajišťují přestup proudu z roztoku na kov
elektrody. Po překročení určitých hodnot napětí proud
již dále neroste, protože difúze částic dosáhla
maximální rychlosti, která je přímo úměrná koncentraci
reagující látky v roztoku (viz níže). Tento maximální
proud se nazývá limitní difúzní proud (na obrázcích
id nebo Il) a je přímo úměrný
koncentraci stanovované látky v roztoku. Sledovaná
závislost proudu na napětí má tvar vlny – polarografická
křivka nebo polarografická vlna.
Obr. Polarizační křivka
Pokud pokračujeme ve zvyšování napětí vkládaného na elektrody, začne se při určité hodnotě rozkládat některá další látka přítomná v roztoku, což může být případně další stanovovaná látka. V tom případě na první vlně roste obdobným způsobem vlna odpovídající elektrochemické reakci této další stanovované látky. Polohy vln vzhledem k ose napětí, jsou závislé na druhu reagujících látek a mohou být použity jako kvalitativní ukazatel (podle toho lze určit látku reagující na elektrodě). Kvalitativní analýza se opírá o hodnotu tzv. půlvlnového potenciálu (E1/2), což je potenciál Hg kapkové elektrody, při kterém dosáhne proud poloviny limitního difúzního proudu. Podle hodnoty lze identifikovat stanovovanou látku.
Nakonec
se začne rozkládat tzv. nosný elektrolyt, což je
látka přidaná do roztoku ke zvyšování vodivosti roztoku.
Polarografická křivka
při stanovení 3 kovů (v roztoku jsou přítomny ionty Cd2+,
Zn2+ a Mn2+) při postupném zvyšování
napětí vkládaného na elektrody klesá potenciál
polarizovatelné rtuťové kapkové elektrody a na elektrodě se
začne nejprve redukovat kov, který se redukuje nejsnáze (tj.
při nejméně záporném potenciálu) - objeví se nejprve vlna
Cd2+, pak při zápornějším potenciálu se objeví
vlna Zn2+ a nakonec i vlna Mn2+.
Potenciály, při nichž se tyto kovy vylučují, jsou
dostatečně odlišné (poloha vln se určuje dle půlvlnového
potenciálu, určován obvykle jako napětí odpovídající
poloviční výšce vlny), takže vlny jsou dobře prokreslené a
všechny tři kovy by bylo možné stanovit postupně jedním
měřením.
Polarizace elektrody znamená změnu potenciálu elektrody průchodem elektrického proudu. Při průchodu elektrického proudu přes elektrodu probíhá na elektrodě elektrochemická reakce (oxidace, či redukce), takže na jejím povrchu a v blízkosti jejího povrchu vznikají nové látky a mění se koncentrace látek. Podle Nernstovy rovnice se pak mění rovnovážný potenciál elektrody.
Např. při vylučování iontů Cd2+ z roztoku na rtuťové kapkové elektrodě vzniká kovové kadmium, které se rozpouští v Hg jako amalgam (vzniká nová látka – místo rtuťové elektrody se vytvoří elektroda s rovnováhou Cd2+ - Cd amalgam, která má jiný – nižší standardní potenciál), a zároveň se snižuje koncentrace iontů Cd2+ v těsné blízkosti elektrody (označíme c0Cd2+) proti vlastní stanovované koncentraci v roztoku dále od elektrody (označíme cCd2+) a současně se zvyšuje koncentrace Cd v amalgamu (camal). Poměr koncentrací v záporném logaritmu rovnice, která určuje potenciál se zvyšuje, a tudíž klesá potenciál elektrody
Při klasické polarografii se jako polarizovatelná elektroda používá malá kapka Hg, která se vytváří na konci tlustostěnné skleněné kapiláry pomalým vytékáním rtuti ze zásobníku rtuti. Kapka pravidelně odkapává (bývá řízený proces) a vytváří se pak nová. Při její nepatrné ploše i velice nízký proud zajistí změny koncentrací na elektrodě v její blízkosti a tedy polarizaci.
Druhá použitá elektroda je nepolarizovatelná, tj. její potenciál se průtokem proudu nemění. Používá se elektroda s velkou plochou, takže nepatrný proud nevyvolá prakticky změnu koncentrací u jejího povrchu (např. přímo rtuťové dno polarografické nádobky nebo některá z běžných referentních elektrod).
Napětí U
vložené na obě elektrody je vyrovnáváno rozdílem mezi
konstatním potenciálem nepolarizovatelné elektrody EN (obvykle
kladná elda - anoda) a měnícím se potenciálem
polarizovatelné elektrody EP (obvykle záporná elda
– katoda) a úbytkem napětí na odporu roztoku elektrolytu
mezi oběma elektrodami I.R.
U= EN
- EP + R.I
Přídavkem silného elektrolytu k roztoku se stanovovanou látkou (zvýšení koncentrace iontů v roztoku) je zajištěn jeho velmi malý odpor roztoku, takže člen IR je prakticky nulový. To tedy znamená, že při zvyšováním napětí U celý přírůstek tohoto vnějšího napětí způsobí pokles potenciálu polarizovatelné katody (vnějším napětím je jí vnucován stále zápornější potenciál), a tím jsou současně určovány koncentrační podmínky na povrchu rtuťové kapky a v její nejbližší okolí v elektrolyzovaném roztoku. (Podmínky v roztoku dále od kapky se nemění – používané proudy jsou tak malé, že elektrolýzou se prakticky nemění složení celého roztoku, ale pouze složení v tenké vrstvičce těsně u rtuťové kapky).
Při vytvoření nové kapky je třeba elektrodu vždy elektricky nabít na vnucovaný potenciál (kapka s okolním roztokem se chová jako kondenzátor). Náboj k tomu potřebný je přiveden prudce klesajícím proudovým nárazem, který se objeví vždy s novou kapkou - tzv. nabíjecí proud. Po proběhnutí pulzu nabíjecího proudu obvodem protéká dále již jen tzv. difúzní proud. To je proud zajišťovaný reakcí jen těch částic stanovované látky (Cd2+), které byly právě přivedeny k elektrodě ze vzdálenějšího roztoku difúzí. Tato difúze je vyvolávána rozdílem koncentrací (I. Fickův zákon) - rozdílem mezi vyšší koncentrací ve vzdálenějším roztoku (stanovovaná koncentrace cCd2+) a nižší koncentrací iontů v těsné blízkosti elektrody (c0Cd2+; koncentrace odpovídající vnucenému potenciálu dle Nerstovy rovnice – viz výše). Velikost difúzního proudu je určována rychlostí difúze a ta opět rozdílem obou koncentrací
cCd2+ - c0Cd2+
Hodnota
difúzního proudu se řídí tzv. Ilkovičovou rovnicí (rovnice
platí pro kapající rtuťovou elektrodu; není třeba se ji
učit); pro střední hodnotu difúzního proudu platí
n-počet vyměňovaných
elektronů dle rovnice, F – Faradayova konstanta, D- difúzní
koeficient, m- hmotnost kapky, doba nárůstu kapky (od vzniku
až po odpadnutí); všechny tyto funkce jsou konstantní pro
danou reagující látku a lze jejich součin nahradit jedinou
konstantou pro daný prvek ?.
Když je zvyšováním vnějšího vkládaného potenciál polarizované elektrody snížen na takovou hodnotu, že odpovídající rovnovážná koncentrace Cd2+ u stěny kapky c0Cd2+ je mnohem menší než koncentrace uvnitř roztoku cCd2+ (tzn. že je prakticky nulová), rozdíl koncentrací ženoucí difúzi je pak roven jen stanovované koncentraci kadmia v roztoku
cCd2+ - c0Cd2+ = cCd2+ - 0 = cCd2+
Rychlost difúze dosáhla svého maxima a nemůže již dále růst. To tedy znamená, že se difúzní proud již dále nemůže zvyšovat – limitní difúzní proud.
Z výkladu
mělo vyplynou, že tento limitní difúzní proud je přímo
úměrný stanovované koncentraci kadmia v roztoku.
Zjednodušená Iľkovičova rovnice vyjadřující závislost
měřeného limitního difúzního id
proudu na koncentraci stanovované látky c:
Je to rovnice kalibrační přímky při polarografii. Hodnotu konstanty ? (chí) určujeme kalibrací, tj. proměřujeme rovnici kalibrační přímky měřením limitních difúzních proudů pro různé známé koncentrace stanovované látky.
Látka, která reaguje na rtuťové
elektrodě a zajišťuje průchod proudu přes tuto elektrodu, se
nazývá depolarizátor. Tento termín byl volen proto, že
nárůst proudu s tím spojený zvyšuje člen IR a o tento
úbytek na odporu se zmenšuje pokles polarizačního potenciálu
rtuťové elektrody Ep – polarizace - při
zvyšování vnějšího napětí vkládaného na elektrody: U= EN - EP
+ R.I.
Depolarizátorem je stanovovaná látka. Při většině
polarografických analýz je stanovovaná látka redukována na
rtuťové elektrodě (elektroda je zapojena jako katoda), např.
kationty kovů. Při stanovení lze však využít i oxidačních
reakcí na kapkové elektrod (pak je zapojena jako anoda);
používá se při stanovení některých organických látek.
Schéma
zapojení klasického polarografu
U většiny analýz je nutno odstranit kyslík z roztoku, protože se redukuje na katodě místo stanovované látky a tím zastíní její polarografickou křivku. kyslík se vytěsní z roztoku probubláváním např. dusík.
Rtuťová
kapková elektroda má řadu výhod proti jiným
polarizovatelným elektrodám, jednou z nich je, že se vodík
vylučuje na Hg při mnohem zápornějším potenciálu než by
dle standardního potenciálu vodíkové elektrody měl,
hovoříme o tzv. přepětí (0,8 V). To umožňuje
polarograficky stanovovat i kovy, které jsou v řadě napětí
za vodíkem (Zn, Al, Ba, Na, K), aniž dochází k jeho
vylučování z roztoku.
Objevitelem polarografie
je akademik
Jaroslav Heyrovský - Nobelova cena za chemii 1959
Amperometrická indikace bodu ekvivalence.
V roztoku, ve kterém stanovujeme určitou látku oxidačně redukční titrací nebo ion kovu srážecí titrací nebo komplexometrickou titrací, máme ponořenu elektrodu polarizovatelnou a nepolarizovatelnou. Na elektrody vložíme vhodně velké vnější napětí a sledujeme závislost limitního difúzního proudu odpovídající koncentraci titrované látky, na objemu titračního činidla. Látka je při titraci odstraňována z roztoku (je odstraňována oxidací nebo redukcí, ion kovu vypadává jako nerozpustná látka, nebo je přeměňován na komplex, který na polarizovatelné elektrodě nereaguje). Proud tedy během titrace lineárně klesá až v bodě ekvivalence dosáhne prakticky nuly. Pokud je titrační činidlo látka, která reaguje na polarizovatelné elektrodě, za bodem ekvivalence proud opět roste. Pokud titrační činidlo nereaguje na elektrodě, proud zůstává za bodem ekvivalence stále prakticky nulový .
Biampérometrická indikace bodu ekvivalence
Na dvě polarizovatelné
elektrody ponořené do titrovaného roztoku je vloženo malé
vnější napětí a sledujeme závislost proudu protékajícího
mezi nimi. Proud protéká tehdy, pokud jsou v roztoku
přítomny dvě látky, z nichž jedna je oxidovatelná na anodě,
druhá redukovatelná na katodě, při potenciálech elektrod,
které se příliš neliší, pokud je vložené malé vnější
napětí větší než rozkladné napětí systému v roztoku.)
Používá se při redoxních titracích, kdy se v průběhu
titrace mění koncentrace oxidovaných a redukovaných forem
titrované látky a titračního činidla.
Obr. Biamperometrické titrační křivky
2. obr. –závislost měřených proudových rozdílů (osa y) na plynule se měnícím potenciálu rtuťové kapkové elektrody (osa x); plocha pod křivkou je úměrná koncentraci stanovované látky (např. iontu kovu). Tři píky znamenají, že byly současně stanovovány tři různé kovy; poloha píku na ose potenciálů závisí na stanovované látce (kvalitativní údaj).
Stanovovaná látka se
vyloučí z roztoku (elektrolyticky, adsorpcí aj.) na povrchu
elektrody (grafit, platina zlato); tím se vlastně zakoncentruje
a pak se elektrolyticky rozpouští, přičemž se měří proud
obdobnými technikami, jako při polarografii - zaznamenává se
polarografická vlna odpovídající rozpouštění kovu z elektrody
do roztoku.Tato metoda patří k nejcitlivějším analytickým
metodám vůbec. Meze detekce řádově až 10-9 i 10-12
mol.dm-3.
ANORGANIC[názvosloví][rovnice][chemie prvků]
ORGANIC[názvosloví][rovnice][reakční mechanismy][pravidla a
pojmenované reakce]
[alkany][alkeny][alkiny][areny][hydroxysloučeniny][karbonylové
sloučeniny][ kyseliny a
jejich deriváty] [halogenderiváty][slouč. N, S, P, As a B][polymery]
OBECCHEM[tabulka][vzorce][programy]
MATCHEM[výpočty vzorců][výpočty z
rovnic][roztoky]
BIOCHEM[sacharidy][lipidy][heterocyklické sloučeniny][bílkoviny][biocykly][přírodní
látky]
ANALYTIC[spektra][pH][indikátory][činidla][důkazy prvků]
GEOCHEM[minerály][krystaly]
HISTORCHEM [objevitelé][ osobnosti][humor]
CHEMICKÁ FYZIKA A FYZIKÁLNÍ CHEMIE[orbitaly][atomové
jádro][pH][elektrochemie][radiochemie][chemická kinetika][termochemie][molekulová fyzika]